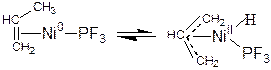Реакция обратная окислительному присоединению называется восстановительным элиминированием.
В реакции окислительного присоединения наиболее реакционно-способны комплексы металлов d8, d10, находящихся в не высших степенях окисления (как правило, 0, +1, +2). К таким относятся комплексы Feo, Ruo, Oso, Rh+1, Ir+1, Nio, Pdo, Pto, Pd+2, Pt+2.
Формально реакцию окислительного присоединения можно представить как гомолитическую диссоциацию молекулы XY:
XY ßà X× + Y× (3.10)
передачу металлом по электрону каждому образовавшемуся радикалу с получением анионов:
[LmMn] + X× + Y× ßà [LmM(n+2)] + X- + Y- (3.11)
и последующее присоединение анионов на свободные координационные места в комплексе окисленного металла:
[LmM(n+2)] + X- + Y- ßà [LmM(n+2)XY] (3.12)
Различают два случая окислительного присоединения.
1) Окислительное присоединение, сопровождающееся полным разрывом связи в присоединяющейся молекуле, и образованием двух монодентантных лигандов:
d8 d6
[Ir1+Cl(CO)(PPh3)2] + HCl ßà [Ir3+HCl2(CO)(PPh3)2] (3.13)
2) Окислительное присоединения молекулы с кратной связью и образованием одного бидентантного лиганда:
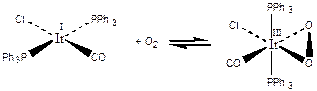 (3.14)
(3.14)
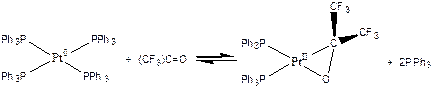 (3.15)
(3.15)
Последняя реакция (3.15), согласно правилу 16/18-электронов, протекает по четырехстадийному механизму: сначала диссоциация одной молекулы трифенилфосфина (комплекс становится 16-электронным), затем монодентантная координация перфторацетона p-электронами карбонильной группы (комплекс становится 18-электронным), затем диссоциация еще одной молекулы трифенилфосфина (комплекс становится 16-электронным), и, наконец, окислительное присоединение, сопровождающееся окислением платины до степени +2, но без изменения числа валентных электронов в комплексе.
Промышленно-важными примерами реакций окислительного присоединения являются следующие:
1. Активация водорода:
[PtIICl(SnCl3)(PPh3)2] + H2 ßà [PtIVClH2(SnCl3)(PPh3)2]
2. Окислительное присоединение галоген-алкилов:
[RhI(CO)2I2] + CH3J ßà [CH3RhIII(CO)2I3]
3. Превращение олефинового лиганда в p-аллильный, в результате разрыва связи С-Н в аллильном положении углеводородного лиганда: