Влияние стерических и электронных факторов на реакционную способность комплексов.
На реакционную способность комплексов в реакциях координирования оказывает влияние как стерическое, так и электронное строение лигандов.
Полуколичественную оценку влияния стерического строения лигандов на величину константы диссоциации комплексов предложил Толман. Параметром, характеризующим степень стерического влияния является конусный угол лиганда. Конусный угол - это угол воображаемого конуса, в который вписана молекула лиганда, с вершиной у центрального атома (Рис. 3.5).
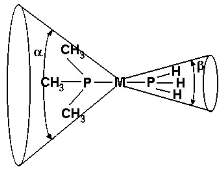
Рис. 3.5. Конусный угол лиганда. a - конусный угол триметилфосфина; b - конусный угол фосфина. a > b.
Чем больше конусный угол лиганда L, тем больше константа диссоциации лиганда Х, находящегося в координационной сфере комплекса. Так, для реакции диссоциации комплексов никеля:
LNiX3 ßà LniX2 + X (3.7)
константа диссоциации (К) зависит от величины конусного угла фосфинового лиганда L следующим образом:
Кон.угол (o): 109 118 130 132 145
L: P(OEt)3 < P(Me)3 < P(O-iPr)3 < PEt3 << PPh3
K: à растет à
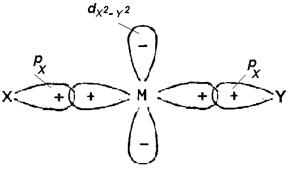
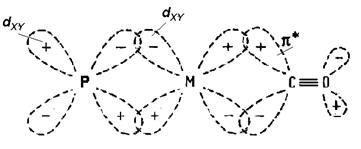
На скорость реакции замещения лигандов сильное влияние оказывает природа транс-расположенного, к замещаемому, лиганда. Это влияние называют ТРАНС-ЭФФЕКТОМ. Транс-эффект объясняется донорно-акцепторным перераспределением электронной плотности по системам s- и p-связей транс-расположенных лигандов через орбитали металла. Схематично природа транс-эффекта проиллюстрирована на Рисунке 3.6.
| 
|
а б
Рис. 3.6. Транс-эффект: а) по системе s-связей; б) по системе p-связей.
Сила транс-эффекта (т.е. увеличение скорости обмена транс-расположенного лиганда) как правило возрастает в ряду:
H2O, HO-, NH3 < Cl- < I- < C6H5- < CH3- < H-, PR3 < C2H4 , CN-, CO
Этот ряд почти совпадает с рядом возрастания мягкости оснований (т.е. с увеличением лабильности донорной электронной пары основания). Транс-эффекту можно дать следующее механистическое объяснение: донирование электронной плотности транс-лигандом либо ослабляет связь уходящего лиганда с атомом металла, либо облегчает образование связи с приходящим лигандом.
В ряде случаев взаимное влияние лигандов и центрального атома хорошо объясняется с позиции концепции ЖМКО. Например, равновесие в реакции замещения иодид-аниона на молекулу воды в комплексе CoIII:
[CoIII(NH3)5I]2+ + H2O ßà [CoIII(NH3)5H2O]3+ + I- (3.8)
сильно смещено вправо. С точки зрения концепции ЖМКО это объясняется тем, что жесткая кислота Co+3 предпочтительно координируется с жесткими основаниями, такими как H2O и NH3, чем с мягким основанием - I-.
3.2.3. ОКИСЛИТЕЛЬНОЕ ПРИСОЕДИНЕНИЕ И ВОССТАНОВИТЕЛЬНОЕ ЭЛИМИНИРОВАНИЕ (REDOX-РЕАКЦИИ).
Координационно-ненасыщенные (то есть, имеющие свободные координационные места) комплексы переходных металлов способны присоединять к себе нейтральные молекулы с разрывом связи в них и увеличением степени окисления металла на +2. Такие реакции называют - окислительным присоединением, и протекают они по следующей схеме:
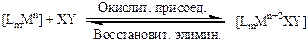 (3.9)
(3.9)








