Комплексы переходных металлов состоят из центрального атома и координационной сферы, образованной координированными с центральным атомом лигандами.
3.
4.
5. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МЕТАЛЛОКОМПЛЕКСНОГО КАТАЛИЗА
Значительная доля гомогенно-каталитических промышленных процессов основана на реакциях катализируемых комплексами переходных металлов. Химия металлоорганических соединений переходных металлов в последние десятилетия бурно развивается в том числе и потому, что они вызывают интерес, как потенциальные катализ
аторы промышленных процессов. Катализ комплексами переходных металлов основан на вовлечении лигандов координационной сферы в химические превращения каталитического цикла. Отличительными чертами металлокомплексного катализа являются высокие скорости реакций, высокая селективность и умеренные температуры.
5.1. СТРОЕНИЕ И СВОЙСТВА КОМПЛЕКСОВ ПЕРЕХОДНЫХ МЕТАЛЛОВ
Переходными металлами называют элементы с частично заполненными d- и f-оболочками. Для промышленного металлокомплексного катализа практическое значение имеют комплексы d-элементов, поэтому долее под переходными металлами будут подразумеваться именно они. Переходные металлы в таблице Менделеева начинаются с элемента 3-ей побочной группы 4 периода - Sc.
Особенностью электронного строения переходных металлов является то, что их атомы имеют близкие по энергии одну ns-, три np- и пять (n-1)d-орбиталей. Пространственное изображение орбиталей дано на рисунке 3.1. Эти девять орбиталей и находящиеся на них электроны способны образовывать координационную связь с ионами и нейтральными молекулами.
Комплексы переходных металлов состоят из центрального атома и координационной сферы, образованной координированными с центральным атомом лигандами.
В зависимости от электронного строения, центральный атом может координировать определенное количество лигандов. Это число называется координационным числом. Наиболее распространенными значениями координационного числа являются 4, 5 и 6, которым соответствуют 5 вариантов пространственной координации лигандов (Рис. 3.2):
координационное число 4 - тетраэдр и квадрат;
координационное число 5 - тетрагональная пирамида и тригональная бипирамида;
координационное число 6 - октаэдр .
Центральный атом комплекса способен образовывать координационную связь с молекулами, атомами и ионами либо акцептируя у них электроны на свои вакантные d-орбитали, либо отдавая свои электроны с внешних орбиталей на вакантные орбитали лиганда. По типу связи с центральным атомом лиганды делят на две группы: s- и p-лиганды.
s -Лиганды бывают трех типов:
1) s-Лиганды, имеющие одну свободную электронную пару и не имеющие энергетически доступных вакантных электронных орбиталей. К этому типу относятся H-, :NH3, R- (алкил) и др. Такие лиганды образуют с центральным атомом одну s-связь. (Рис. 3.3 (1)).
2) s-Лиганды, имеющие несколько свободных пар электронов. К этому типу относятся HO-, Cl-, F- и др. Такие лиганды способны образовывать дополнительную p-связь с вакантными орбиталями атома металла.(Рис. 3.3 (2)).
3) s-Лиганды, которые помимо свободных пар электронов имеют энергетически доступную вакантную p-орбиталь (например p*-антисвязывающая орбиталь в молекулах СО, NO). Они образуют дополнительную p-связь за счет передачи электронов металла на вакантную p*-орбиталь лиганда (такое явление называют обратным p-связыванием). Обратное p-связывание приводит к ослаблению связи С-О в молекуле монооксида углерода, делая ее значительно более реакционноспособной.(Рис. 3.3 (3)).
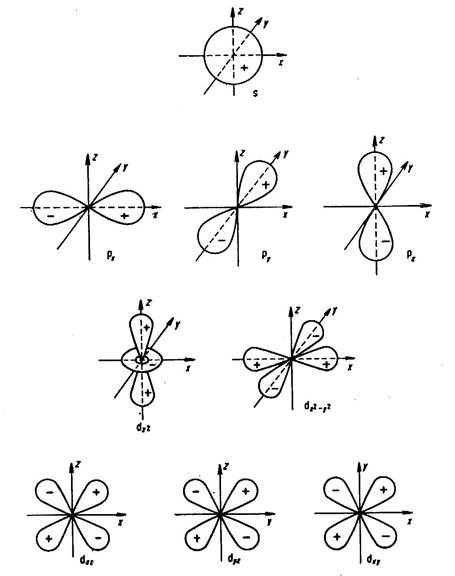
Рис 3.1. Пространственное изображение атомных орбиталей.
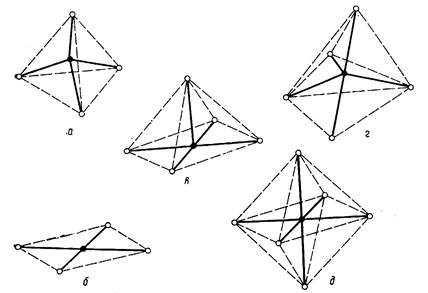
Рис 3.2. Пространственное расположение лигандов в комплексах переходных металлов: а) Тетраэдр; б) Квадрат; в) Тетрагональная пирамида; г) Тригональная бипирамида; д) октаэдр.
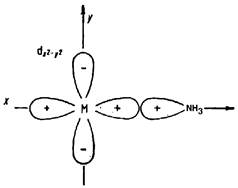
| 1) Образование s -связи между вакантной dX 2 - Y 2 орбиталью металла и свободной парой электронов аммиака. | | |
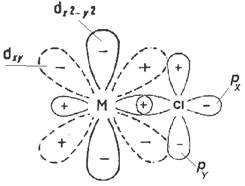
| 2) Образование s -связи между вакантной dX 2 - Y 2 орбиталью металла и свободной парой электронов на pX орбитали хлора и p -связи между вакантной dXY орбиталью металла и свободной парой электронов на pY орбитали хлора. | | |
|
3) Образование s -связи между вакантной dX 2 - Y 2 орбиталью металла и свободной парой электронов на sp -гибридной орбитали углерода и образование p -связи между парой электронов на dXY орбитали металла и свободной разрыхляющей p * -орбиталью молекулы СО. | 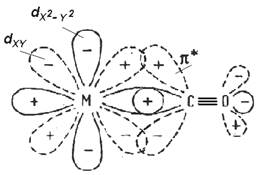
| |
Рис 3.3. Различные типы s-лигандов и образуемые ими связи с центральным атомом комплекса.
p -Лиганды имеют донорные пары p-электронов, которые образуют s-связь с вакантной орбиталью металла. Это алкены, алкины, диены, ароматические соединения . С алкенами координационная s-связь образуется за счет электронов p-связи и свободной d-орбитали металла (Рис. 3.4). Кроме того образуется дополнительная p-связь за счет d-электронов металла и p*-антисвязывающей орбитали олефина. Оба типа связи приводят к ослаблению двойной связи в олефине, что делает ее более реакционно-способной.
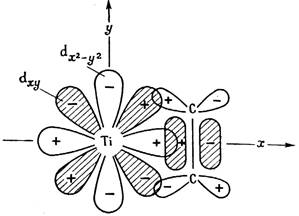
Рис 3.4. Образование s- и p-связей между этиленом и атомом титана.
Аллильные лиганды способны образовывать как p-, так и s-связь с атомом металла и обратимо перегруппировываться в координационной сфере:
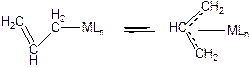 (3.1)
(3.1)
При перегруппировке s-аллильного лиганда в p-аллильный - один электрон s-связи и 2 электрона p-связи аллила делокализуются и аллильная группа ведет себя по отношению к металлу, как система с тремя валентными электронами на трех валентных p-орбиталях.
Помимо аллильного лиганда существуют и другие, которые способны предоставлять, в зависимости от степени делокализации, различное количество электронов на образование связи с центральным атомом. Наряду с упомянутой выше номенклатурой, кслассифицирующей такие изомерные лиганды на s- и p-лиганды, существует еще одна, предложенная Коттоном. По этой номенклатуре лигандам, способным изомеризоваться из s- и p-форму, добавляется приставка hn-, где h (гапто-) - буква греческого алфавита (начальная буква в греческом слове “хватать”), а индекс n показывает сколько электронов лиганда образует связь с центральным атомом. Например:
(h1-С3Н5)Mn(CO)5 - моно-гаптоаллилпентакарбонилмарганец (s-аллильный лиганд)
(h3-С3Н5)Mn(CO)4 - три-гаптоаллилтетракарбонилмарганец (p-аллильный лиганд)
(h5-С5Н5)2Fe - ди(пента-гаптоциклопентадиенил)железо
Как уже было показано выше, атом металла и координированные вокруг него лиганды могут образовывать различные типы связей. Но для упрощения описания металлокомплексных каталитических реакций, формально всегда считают, что атом металла имеет заряд 0 или >0, а лиганды всегда либо нейтральны, либо отрицательно заряжены. То есть, к примеру, лиганд (Н) - это всегда гидрид - Н-, а алкил (R) - всегда карбанион - R-.
5.2. КЛЮЧЕВЫЕ РЕАКЦИИ В ГОМОГЕННОМ МЕТАЛЛОКОМПЛЕКСНОМ КАТАЛИЗЕ
3.2.1. ПРАВИЛО 16/18-ЭЛЕКТРОНОВ
На основании анализа огромного экспериментального материала по реакциям металлокомплексных соединений Толманом было сформулировано правило 16/18-электронов. Это правило отражает тот факт, что наиболее устойчивыми являются комплексы, имеющие 16 или 18 валентных электронов на внешней (валентной) электронной оболочке металла. Соответственно, все химические превращения комплексов переходных металлов протекают через промежуточные стадии образования 16- или 18-электронных комплексов. Это означает, что на одной элементарной стадии химического превращения изменение количества валентных электронов в комплексе может составлять только 0, +2 и -2. Очевидно, что 18-электронное состояние - это предельное электронно-насыщенное состояние центрального атома, соответствующее полному заполнению всех девяти внешних (валентных) орбиталей металла. 14-ти и менее электронные комплексы встречаются крайне редко ввиду их высокой реакционной способности, вызванной стремлением пополнить валентные орбитали электронами до 16/18-электронного состояния.
Под валентными электронами комплекса подразумевают электроны, расположенные на валентных орбиталях металла. Число валентных электронов считают следующим образом:
| (Число валентных электронов) = (Все электроны металла на ns -, np - и ( n -1) d -орбиталях, с учетом степени окисления металла) + (по 2 электрона от каждого монодентантного лиганда) + (по n электронов от h n -лигандов + заряд лиганда) | (3.2) |
Например:
[RhICl(PPh3)3]
Атом родия в степени окисления +1 имеет 8 электорнов; комплекс содержит 4 монодентантных лиганда, каждый из которых предоставляет по 2 электрона на образование координационной связи; таким образом число валентных электронов в комплексе составляет:
8 + (4´2) = 16
Аналогичным образом рассчитывают валентные электроны для любых комплексов:
[СН3MnI(CO)5] 6 + (6´2) = 16
[(h5-С5Н5)2FeII] 6 + 2´(5 + 1) = 18
В процессе каталитической реакции с участием металлокомплексного катализатора реагент из реакционного раствора должен войти в координационную сферу комплекса, подвергнуться там химическому превращению, а образовавшийся продукт (или полупродукт) должен покинуть координационную сферу и выйти в раствор.
Существует всего несколько типов элементарных реакций, комбинацией которых можно описать любые каталитические процессы с участием комплексов переходных металлов. Причем, согласно правилу 16/18-электронов, изменение количества валентных электронов в комплексе на этих элементарных стадиях может составлять только 0, +2 и -2. Такие реакции еще называют ключевыми. Рассмотрим их.
3.2.2. КООРДИНИРОВАНИЕ (ПРИСОЕДИНЕНИЕ, ДИССОЦИАЦИЯ И ЗАМЕЩЕНИЕ ЛИГАНДОВ)
Диссоциация и координирование лиганда является обратимой реакцией. В качестве примера можно привести следующую:
[Pt(PPh3)4] ßà [Pt(PPh3)3] + PPh3 (3.3)
В реакции диссоциации число валентных электронов комплекса уменьшается на 2. Обычно реакции диссоциации 18-электронных катализаторов являются первой стацией каталитического цикла, так как образующийся 16-электронный комплекс является электронно-ненасыщенным и способен координироваться с реагентом.
Замещение лигандов, может протекать по двум механизмам. Первый из них - диссоциативный механизм ( SN 1). Для реакции:
LnMX + Y à LnMY + X
данному механизму соответствует следующая схема:
LnMX à LnM + X (медлено) (3.4)
LnM + Y à LnMY (быстро)
Второй механизм - ассоциативный ( SN 2). Он протекает по следующей схеме:
LnMX+ Y à [Y××××LnM××××X] à LnMY + X (3.5)
Еще один механизм, по которому могут протекать реакции координирования - это гетеролитическое присоединение. К нему относят реакции, протекающие по схеме:
LnM + XY à L(n-1)MX + Y+ + L- (3.6)
Формально такой механизм можно рассматривать, как диссоциацию вещества XY на ионы (X- и Y+), с последующим замещением лиганда L- на Х-. Примером служит реакция гетеролитического присоединения водорода к комплексу рутения - одна из стадий в процессах гидрирования:
[RuIICl2(PPh3)3] + H2 à [RuIIClH(PPh3)3] + H+ + Cl-