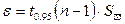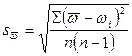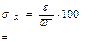Минералогический и химический состав горных пород, руд и минералов меди
По минералогическому составу и характеру вмещающей породы различают несколько типов медных руд. Промышленные типы медных руд следующие:
-- Пластовые руды (монометаллические руды);
-- Медные nорфировые руды, это монометаллические руды, содержащие иногда молибден. Вмещающая порода – гранит-порфиры, гранодиорит-порфиры и др. Первичные руды содержат 2 – 5% халькопирита и пирита, реже встречается халькозин. 90 – 95% общей массы руды составляют кремнийсодержащие минералы, среди которых преобладает кварц (60 – 95%); остальная часть породы представлена серицитом;
-- Колчеданные руды. В этих рудах 95% и более от общей массы руды составляют сульфиды железа – пирит и, редко, пирротин. Колчеданные руды делятся по содержанию меди, цинка и серы. Серный колчедан с содержанием ниже 0,7% Си, ниже 2% Zn, выше 35% S, ниже 16% нерастворимого остатка. Медистый колчедан с содержанием 0,7% Си и выше, ниже 2% Zn. Цинково-медистый колчедан с содержанием выше 0,7% Си и 2% и выше Zn;
-- Медно-молибденовые и медно-никелевые руды.
Известно около 170 минералов, содержащих медь. По своему химическому составу они разделяются на следующие группы: самородная медь, сульфиды и арсено-сульфиды, селениды и теллуриды, галоидные соединения, окислы, карбонаты, силикаты, фосфаты, сульфаты.
Промышленное значение имеют следующие минералы:
-- Халькопирит, медный колчедан CuFeS2 или Сu2SFе2SЗ Первичный сульфид, встречается почти во всех месторождениях медных руд; часто в тесном срастании с пиритом;
-- Борнит, 2Cu2S∙CuFe2S. Первичный минерал меди.
-- Халькозин, медный блеск, Cu2S;
-- Ковеллин, CuS. Оба минерала являются вторичными сульфидами, которые образовались при взаимодействии продуктов окисления халькопирита с пиритом и сульфатом меди;
-- Куприт, красная медная руда, Сu2О. Продукт окисления сульфидов меди; встречается в сочетании с другими окисленными минералами меди;
-- Тенорит, СuО. В мелкозернистой форме называется мелаконитом;
-- Атакомит, ремолинит, СuСI2∙ЗСu(ОН)2. Основной хлорид меди, встречается как вторичный минерал в зоне окисления;
-- Диоптаз, аширит, медный изумруд H2CuSi04. Кислая кремнекислая медь, прозрачные кристаллы;
-- Хризоколла H2CuSi04 Н2О или СuSiO3·2Н2О – водная кислая кремнекислая медь;
-- Малахит, медная зелень СuСО3 Си(ОН)2 – основной карбонат меди, образуется в результате окисления сульфидов меди в сульфаты и взаимодействия последних с известняком;
-- Азурит, медная лазурь, медная синь 2СuСОз· Си (ОН)2 – основной карбонат меди, соль, более бедная медью, чем малахит;
-- Халькантит, или медный купорос или сульфат меди – CuS04 5Н2О; синий минерал, растворимый в воде.
Как видно из перечисленного списка руд, содержание меди в рудах менее 1 %. Для таких объектов применяют физические методы химического анализа. Химические методы химического анализа применяют в основном для анализа состава минералов при содержании минералообразующих элементов в них более 1 %.
Из химических методов определения минералообразующих элементов в минералах, таких как медь, сурьма, цинк, олово, мышьяк, селен, теллур, применяется метод йодометрии.
Определение меди(II) методом йодометрии
Йодометрический метод определении Cu(II) основан на реакции восстановления йодидом калия двухвалентной меди до одновалентной формы; при этом выделяются мало растворимый в разбавленных кислотах йодид одновалентной меди и элементарный йод:
2CuSO4 + 4KJ = 2CuJ ¯ + J2 + 2K2SO4 (1)
Выделившийся йод титруют раствором тиосульфата натрия. Реакция протекает по уравнению
J2 + 2Na2S2O3 = 2NaJ + Na2S4O6 (2)
По окислительным потенциалам систем J2/2J- (0,62 В) и Cu2+/Cu+ (0,17 В) реакция (1) должна протекать справа налево (т. е. йод должен окислять одновалентную медь). Но йодид меди (І) – малорастворимая соль, поэтому потенциал системы Cu2+, J-/CuJ↓ возрастает до 0,86 В вследствие очень высокой концентрации ионов двухвалентной меди по сравнению с ионами одновалентной меди, и реакция количественно протекает слева направо.
Согласно закону эквивалентов в первой реакции
nэ(CuSO4 ) = nэ(J 2 ),
Во второй реакции nэ(J 2 )= nэ(Na2S2O3).
Тогда nэ(CuSO4 ) = nэ(Na2S2O3)
В лабораторной работе предлагается использовать способ заместительного титрования отдельной навески. В этом способе титрования точно измеренную массу пробы вещества растворяют в конической колбе для титрования в небольшом произвольном объёме растворителя. Добавляют в колбу необходимые реагенты и титруют далее выделившийся в эквивалентном количестве продукт реакции J2.
Для расчета массы компонента А, m(A), используют формулу, полученную из закона эквивалентов:
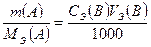 ; тогда
; тогда 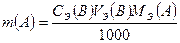 ; (г);
; (г);
где VЭ(B) – эквивалентный, измеренный бюреткой, объем титранта В, израсходованный на титрование растворенной навески вещества, содержащего компонент А, см3;
СЭ(В) – молярная концентрация эквивалентов титранта В, моль/дм3;
Мэ(А) – молярная масса эквивалентов компонента А, г/моль .
Затем по найденной массе компонента А определяют его массовую долю, w(А), в навеске анализируемого вещества (mвещ):
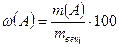 ; %.
; %.
Способ титрования отдельных навесок, при котором объем измеряют только один раз бюреткой, дает более точные результаты, чем способ титрования аликвоты, при котором объем измеряют три раза (в мерной колбе, пипеткой и бюреткой). Однако способ титрования аликвоты требует меньшей затраты времени вследствие уменьшения количества взвешиваний.
Перевод пробы минерала в растворённое состояние. Для проведения анализа минерала методом йодометрии он должен быть переведен в растворенное состояние. Пример перевода образца минерала, содержащего медь в количестве 0.1 – 1%, в растворенное состояние: Навеску минерала, растертого в порошок, растворяют в соляной кислоте при нагревании, прибавляют азотную кислоту, нагревают до кипения и затем выпаривают раствор досуха. К сухому остатку прибавляют соляную кислоту и вновь выпаривают досуха. Соли растворяют в соляной кислоте при нагревании, переводят раствор в мерную колбу, доливают до метки водой и перемешивают. Полученный раствор фильтруют через сухой фильтр в сухой стакан. Если испытуемый минерал содержит неразлагаемые кислотами соединения меди, сухой остаток растворяют в соляной кислоте при нагревании, прибавляют воду, нагревают до кипения и фильтруют на фильтр средней плотности, содержащий фильтро-бумажную массу. Осадок на фильтре промывают n раз разбавленной соляной кислотой, затем горячей водой до исчезновения желтой окраски фильтра. Фильтр с осадком помещают в платиновый тигель, озоляют и прокаливают при 500 – 600 °С. К остатку прибавляют капли воды, капли серной кислоты, фтористоводородную кислоту и выпаривают досуха. Сухой остаток сплавляют с углекислым натрием в муфельной печи при 950 – 1000 °С. После охлаждения плав выщелачивают в соляной кислоте, и полученный раствор присоединяют к основному. Объединенный фильтрат выпаривают до определённого объёма, охлаждают, переносят в мерную колбу, доливают до метки водой и перемешивают.
Удаление мешающих компонентов. В медных рудах всегда присутствует железо. Если пробу разлагают царской водкой или азотной кислотой, то железо переходит в исследуемый раствор в виде ионов Fe3+, которые мешают йодометрическому определению меди, так как также выделяют йод из йодида калия. Реакция протекает по уравнению
2Fe3+ + 2J- = 2Fe2+ + J2
Чтобы сделать возможным йодометрическое определение меди в присутствии железа, к анализируемому раствору добавляют фторид калия или аммония, с которыми трехвалентное железо образует комплексный ион FeF63-, не реагирующий с йодидом калия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1. Средства измерения, вспомогательное оборудование, реактивы и растворы:
-- Весы аналитические;
-- Бюретка вместимостью 25 см 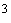 , 2-го класса точности по ГОСТ 29251 ;
, 2-го класса точности по ГОСТ 29251 ;
-- Na2S2O3 , стандартный р аствор с молярной концентрацией эквивалентов 0.05 моль/дм 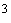 ;
;
-- Мерный цилиндр (мензурки) по ГОСТ 1770;
-- Колбы конические по ГОСТ 25336;
-- Стаканы химические термостойкие вместимостью 100 – 150 см3 по ГОСТ 25336 ;
-- Крахмал, свежеприготовленный 1%-ый раствор;
-- Йодид калия, KJ, 10%-ный раствор;
-- Серная кислота, H2SO4, 1 моль/дм3;
-- Вода дистиллированная по ГОСТ 6709.
Стандартный образец состава минерала халькантита приготовлен как стандартный образец состава предприятия из реактива сульфата меди – CuS04∙ 5Н2О, х.ч., с добавкой хлорида натрия как аналога соли породообразующего элемента натрия, получающейся при растворении минерала в соляной кислоте.
2. Порядок проведения определений содержания меди в пробе вещества стандартного образца состава предприятия (СОП)
1. Закрытую банку с СОП медленно вращают в разных направлениях с целью устранения влияния расслоения твердой смеси, затем аккуратно перемешивают содержимое стеклянной палочкой. Необходимое для анализа количество вещества СОП отбирают шпателем в разных местах банки, где хранится СОП.
2. Взвешивают на аналитических весах 1,00 - 2,00 г вещества СОП с точностью до 0,01 г.
3. Ссыпают навеску вещества СОП в коническую колбу для титрования, добавляют в колбу мерным цилиндром 1 см3 0,1 моль/дм3 раствора H2SO4 для предотвращения гидролиза соли меди (II) и растворяют в небольшом объеме дистиллированной воды, чтобы среда была слабокислой (рН 4 – 5). Известно, что в кислой среде J--ион окисляется кислородом воздуха до молекулярного йода: (4J-+02+4H+=2J2+2H20). Эта побочная реакция мешает определению, так как выделится большее, чем эквивалентное, количество йода. Кроме того, молекулярный йод проявляет окислительные свойства в средах, близких к нейтральной, поэтому анализ следует вести в слабокислой среде.
4. Раствор тщательно перемешивают до полного растворения вещества СОП.
5. Добавляют в ту же колбу мерным цилиндром 10 см3 10%-ного раствора KJ. В анализируемом растворе выпадает осадок CuJ¯ цвета слоновой кости и выделяется молекулярный йод, окрашивая раствор с осадком в коричнево-бурый цвет.
6. Ставят колбу, накрыв её часовым стеклом, в темное место на 5 минут для полного выделения йода.
7. Заполняют бюретку стандартным раствором титранта Na2S2O3, устанавливая уровень жидкости на нулевой отметке бюретки по нижнему краю мениска.
8 Титруют выделившийся в конической колбе йод стандартным раствором тиосульфата натрия Na2S2O3 до перехода коричнево-бурой окраски в соломенно-желтую.
9. Затем в коническую колбу прибавляют к анализируемому раствору 20 капель индикатора – раствора крахмала, после чего окраска раствора с суспензией CuJ¯ становится фиолетово-сине-серой.
10. Продолжают титрование раствора с суспензией CuJ¯ до исчезновения фиолетово-сине-серой окраски титруемого раствора и появления окраски суспензии CuJ цвета «слоновой кости» от одной лишней капли раствора титранта Na2S2O3.
11. Измеряют по бюретке эквивалентный объём титранта с точностью до сотых долей, см3, записывают результат измерения в таблицу 1.
3. Обработка результатов определения
12. Рассчитывают %-ное содержание меди в пробе вещества СОП по формулам, табл.1.
Таблица 1. Исходные данные, измеренные массы, эквивалентные объёмы, расчетная формула, результаты расчета
| MЭ(Cu2+) = 63.55 г/мольCЭ(Na2S2O3) =0,05 моль/дм3 mсовка = г mсовка+вещ = г mвещ = г Vэ1= см3 | 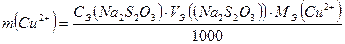 = г
ω(Сu) =
= г
ω(Сu) = 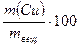 = (%) = (%)
|
13. Обрабатывают результаты определений, полученные в группе (n ≥6), методом математической статистики, табл.2.
Таблица 2. Результаты определений и оценка случайной составляющей погрешности результата определения %-го содержания меди в пробе вещества СОП
| № | ω i |
| (  - ω i)2 - ω i)2
| 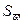
|
| |
| 1 |
|
| t0.95(5)=2.57 t0.95 (6)=2.45 t0.95(7)=2.37 t0.95(8)=2.31 t0.95(9)=2.26 t0.95 (10)=2.23 t0.95(11)=2.20 t0.95(12)=2.18 t0.95(13)=2.16
|
ε =
σR = ; %
| ||
| 2 | ||||||
| 3 | ||||||
| 4 5 6 7 8 9 10 11 | ||||||
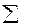 = =
| 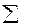 = =
| |||||
Примечание:
ωi – результат определения % -го содержания меди в пробе вещества каждым студентом;
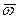 – среднее арифметическое результатов определения %-го содержания меди в пробе вещества;
– среднее арифметическое результатов определения %-го содержания меди в пробе вещества;
n – число определений;
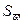 – стандартное отклонение результатов определения;
– стандартное отклонение результатов определения;
ε – оценка случайной составляющей погрешности результатов определения в абсолютных единицах;
t0.95 (n-1) – коэффициент Стъюдента для доверительной вероятности Р = 0,95;
σR – оценка случайной составляющей погрешности результатов определения в относительных единицах (относительное стандартное отклонение результатов определения), %.
4. Приемлемость результатов определений (метрологические характеристики)
4.1 Межлабораторную приемлемость результатов определений оценивают исходя из следующего. Установлено требование, что для СОП аттестуемые значения содержаний компонентов должны быть определены со случайной составляющей погрешности в 2,5 раза меньшей, чем погрешность рядового определения, которую характеризуют допустимым относительным стандартным отклонением, σr, % . Например, для содержаний меди в пробах в различных диапазонах допустимые относительным стандартные отклонения, σr, %, рядового определения приведены в таблице 3. [Методические основы исследования химического состава горных пород, руд и минералов/Под ред. Г.В.Остроумова. – М.: Недра, 1979. – 400 с.]
Таблица 3. Допустимые относительным стандартные отклонения, σr, %
| Интервалы содержания меди, % | σr; % | Интервалы содержания меди, % | σr; % | Интервалы содержания меди, % | σr; % |
| 5,00 - 9,99 | 2,1 | 0,500 – 0,999 | 7,0 | 0,050 – 0,099 | 20 |
| 2,00 – 4,99 | 3.5 | 0,200 – 0,499 | 11 | 0,020 – 0,049 | 25 |
| 1,00 – 1,99 | 5,0 | 0,100 – 0,199 | 14 | 0,010 – 0,019 | 30 |
Следовательно, для содержаний меди в пробе вещества СОП в диапазоне (2,00 – 4,99 ) %, табл.3, допустимое относительное стандартное отклонение, σR, должно быть не более 1,4 % (3.5/2,5 = 1,4 %).
σR = ; % ≥ 1,4 % или ≤ 1,4 %
4.2 Правильность результатов определений в абсолютных единицах оценивают, исходя из условия ∆ = 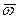 - ωпоз,,
- ωпоз,,
где ωпоз – принятое опорное значение %-го содержания меди в веществе СОП, равное
∆ =
Правильность результатов определений в относительных единицах оценивают по формуле:
δ= 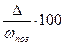 ;% δ= %
;% δ= %
5. Оформление результатов определения %-го содержания меди в пробе вещества СОП
За результат анализа стандартного образца состава вещества предприятия по показателю «содержание меди, %» принимают среднеарифметическое значение результатов определений в условиях воспроизводимости, 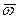 , %;
, %;
14. Результат анализа пробы вещества стандартного образца состава по показателю «содержание меди, %» представляют в виде:
ω = 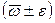 , %, Р=0,95;
, %, Р=0,95;
где ±ε – границы интервала, в котором случайная составляющая погрешности определения находится с доверительной вероятностью Р = 0,95
ω = ( ± ) %; Р=0,95;
Выводы по выполненной лабораторной работе
1. Объект химического анализа –
2. Определяемый компонент –
3. Выполненные виды химического анализа –
4. Метод химического анализа –
4.1. Принцип химического анализа –
4.2. Способ сравнения с эталоном –
4.3. Средства измерения –
4.4. Аналитический сигнал –
4.5. Способ получения результата анализа –
5. Результат химического анализа пробы вещества стандартного образца состава минерала –
6 Сравнение с допустимым относительным стандартным отклонением, σr, –
7. Качество полученного результата анализа стандартного образца состава минерала по показателю «содержание меди, %» –
Приемлемое Неприемлемое