Тема лекции: карбоновые кислоты в группе ТК-9-11, преподаватель Толокнова Т.Н.
План лекции
1. Характеристики и физические свойства карбоновых кислот.
2. Получение карбоновых кислот.
3. Химические свойства карбоновых кислот.
4.Применение карбоновых кислот.
1 Характеристики и физические свойства карбоновых кислот
Органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединенных с углеводородным радикалом, называют карбоновыми кислотами.
Первые три члена гомологического ряда карбоновых кислот, включая пропионовую кислоту, — жидкости, имеющие резкий запах, хорошо растворимые в воде. Следующие гомологи, начиная с масляной кислоты, — также жидкости, обладающие резким неприятным запахом, но плохо растворимые в воде. Высшие кислоты, с числом атомов углерода 10 и более, представляют собой твердые вещества, без запаха, нерастворимые в воде. В целом, в ряду гомологов с увеличением молекулярной массы уменьшается растворимость в воде, уменьшается плотность и возрастает температура кипения (табл. 1).
Таблица 1. Гомологический ряд карбоновых кислот.
| Формула | Название | Плотность, г/см3 | Температура кипения, oС |
| H-COOH | Муравьиная (метановая) | 1,220 | 100,7 |
| CH3-COOH | Уксусная (этановая) | 1,049 | 118,1 |
| CH3-CH2-COOH | Пропионовая (пропановая) | 0,992 | 141,4 |
| CH3-CH2-CH2-COOH | Масляная (бутановая) | 0,964 | 163,5 |
| CH3-(CH2)3-COOH | Валериановая (пентановая) | 0,939 | 186,4 |
| CH3-(CH2)4-COOH | Капроновая (гексановая) | 0,929 | 205,3 |
| CH3-(CH2)5-COOH | Энантовая (гептановая) | 0,910 | 222 |
2 Получение карбоновых кислот
Карбоновые кислоты получают окислением предельных углеводородов, спиртов, альдегидов. Например, уксусную кислоту – окислением этанола раствором перманганата калия в кислой среде при нагревании:
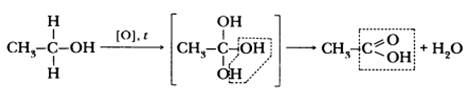
3 Химические свойства карбоновых кислот
Химические свойства карбоновых кислот обусловлены в первую очередь особенностями их строения. Так, растворимые в воде кислоты способны диссоциировать на ионы:
R-COOH↔R-COO— + H+.
Благодаря наличию в воде иона H+ они имеют кислый вкус, способны менять окраску индикаторов и проводить электрический ток. В водном растворе эти кислоты – слабые электролиты.
Карбоновые кислоты обладают химическими свойствами, характерными для растворов неорганических кислот, т.е. взаимодействуют с металлами (1), их оксидами (2), гидроксидами (3) и слабыми солями (4):
2CH3-COOh + Zn → (CH3COO)2Zn + H2↑ (1);
2CH3-COOH + CuO→ (CH3COO)2Cu + H2O (2);
R-COOH + KOH → R-COOK + H2O (3);
2CH3-COOH + NaHCO3→ CH3COONa + H2O + CO2↑ (4).
Специфическое свойство предельных, а также непредельных карбоновых кислот, проявляемое за счет функциональной группы, — взаимодействие со спиртами.
Карбоновые кислоты взаимодействуют со спиртами при нагревании и в присутствии концентрированной серной кислоты. Например, если к уксусной кислоте прилить этиловый спирт и немного серной кислоты, то при нагревании появляется запах этилового эфира уксусной кислоты (этилацетата):
CH3-COOH + C2H5OH ↔CH3-C(O)-O-C2H5 + H2O.
Специфическое свойство предельных карбоновых кислот, проявляемое за счет радикала, — реакция галогенирования (хлорирования).
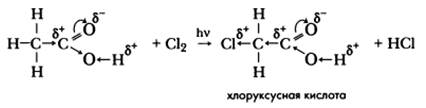
4 Применение карбоновых кислот
Карбоновые кислоты служат исходным сырьем для получения кетонов, галогенангидридов, виниловых эфиров и других важных классов органических соединений.
Муравьиная кислота широко применяется для получения сложных эфиров, используемых в парфюмерии, в кожевенном деле (дубление кож), текстильной промышленности (как протрава при крашении), в качестве растворителя и консерванта.
Водный раствор (70-80%-ной) уксусной кислоты называется уксусной эссенцией, а 3-9%-ный водный раствор – столовым уксусом. Эссенция нередко используется для получения уксуса в домашних условиях путем разведения.
Контрольные вопросы
1. Дайте определение карбоновым кислотам.
2. Перечислите физические свойства.
3. Назовите область применения уксусной кислоты.








