Нарушения белкового обмена
1. Мальабсорбция (нарушение переваривания белков)
Причины нарушения переваривания белков:
1. Нарушение секреции соляной кислоты - снижается кислотность желудочного сока, что ведет к уменьшению набухания пищевых белков в желудке и ослаблению превращения пепсиногена в его активную форму — пепсин.
2. Нарушение функции поджелудочной железы - нарушается поступление в кишечник сока поджелудочной железы, что приводит к дефициту трипсина, химотрипсина и других протеаз. В этих условиях часть белковых структур переходит из желудка в двенадцатиперстную кишку в неизмененном состоянии, что затрудняет действие трипсина, химотрипсина и других протеолитических ферментов кишечника.
При нарушении секреции соляной кислоты и нарушении функции поджелудочной железы происходит ускорение перистальтики. Ускоренное перистальтики вызывает ускоренное прохождение пищевых масс по кишечнику. Это ведет к резкому сокращению времени контакта содержимого химуса с поверхностью энтероцитови всасывания аминокислот. Нерасщепленные белки поступают в толстый кишечник, где под влиянием микрофлоры начинаются процессы гниения, приводящие к образованию активных аминов (кадаверин, тирамин, путресцин, гистамин) и ароматических соединений типа индола, скатола, фенола, крезола. В условиях резкого усиления процессов гниения возможна интоксикация организма.
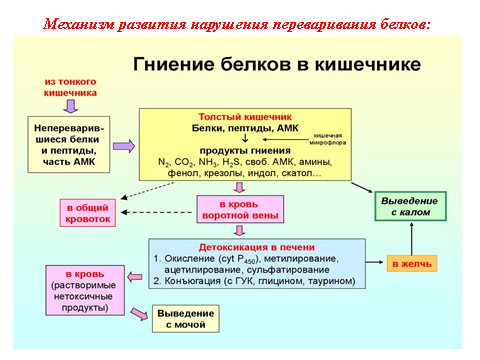
Схема: нарушение переваривание белков
2. Белковая недостаточность
Клинические формы дистрофии: Квашиоркор. Алиментарная дистрофия


Квашиоркор— вид тяжёлой дистрофии на фоне недостатка белков в пищевом рационе. Это название произошло от одного из языков побережья Ганы, и буквально означает «первый-второй», и означает «отвергнутый», отражая, что состояние начинается у старшего ребенка после отлучения от груди, часто из-за того, что в семье родился еще один ребенок.
Патогенез. Болезнь возникает из-за дефицита одного из нескольких видов питательных веществ (например, железа, фолиевой кислоты, йода, селена, витамина С), особенно тех, которые необходимы для выработки защитных антиоксидантов. Продолжительная алиментарная белковая недостаточность вызывает у больных значительные нарушения функции всех органов и систем.
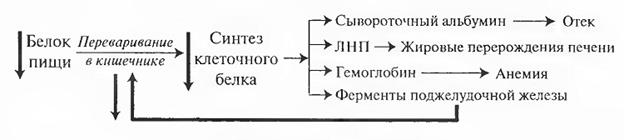
Схема: Патогенез Квашиоркора
Алиментарная дистрофия (алиментарный маразм) – заболевание, характеризующееся тяжелой белковой и чаще более выраженной энергетической недостаточностью. Основные проявления - потеря массы тела более 20% (или ИМТ менее 16), сухость и дряблость кожи, ломкость волос и ногтей, вялость, сонливость и слабость, повышенный аппетит.
Причиной алиментарного маразма служит длительное голодание, во время которого в организм поступает недостаточное количество питательных веществ и энергии. При этом учитывается и их относительная недостаточность: когда поступление калорий не соответствует их расходу.
Патогенез:
Развитие дистрофии возможно только при длительном энергетическом голодании. При этом в организме сначала полностью истощаются запасы гликогена и жиров, затем для обеспечения основного обмена используются запасы внутритканевого белка. В первую очередь процессы дистрофии начинаются в коже, мышцах, затем задействуются внутренние органы, в самую последнюю очередь – жизненно важные (сердце, почки и мозг). На последних стадиях заболевания в организме истощаются запасы витаминов и минералов, перестает функционировать иммунная система. Летальный исход обычно наступает или от сердечной недостаточности, или от присоединившейся инфекции на фоне значительного угнетения иммунитета.
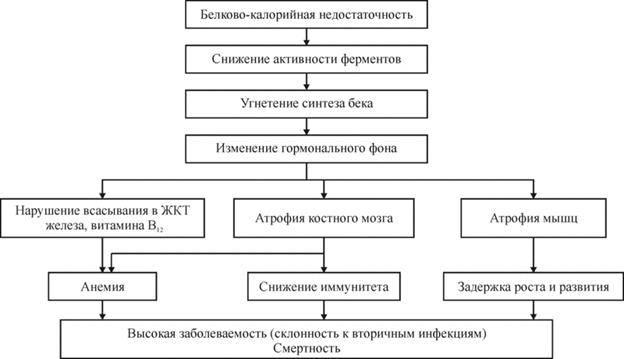
Схема: Патогенез алиментарной дистрофии
3. Нарушение поступления аминокислот в органы и ткани
Аминоацидурия – это синдром нарушения обмена и транспорта из организма одной или нескольких аминокислот. Выявляется при множестве обменных заболеваний, связанных с патологией клеточных мембран в почечных канальцах, как правило, имеющих генетическую природу.
Распространенность данного синдрома относительно высокая, составляет 1:1000 человек, чаще встречается у лиц женского пола и диагностируется при рождении, но бывает и приобретенная аминоацидурия, которая может проявиться в любом возрасте.
Классификация
В зависимости от патогенеза развития разделяют несколько форм состояния:
1. Почечная – содержание кислот в организме снижено за счет недостаточности транспортных ферментативных систем и реабсорбции в почечных канальцах, наблюдается данное состояние при гомоцистинурии, болезни Хартнупа, характеризуется грубыми нарушениями психомоторного развития, атрофией зрительного нерва, судорожным синдромом, деформацией позвоночника и конечностей.
2. Предпочечная – повышается содержание аминокислот в связи с ферментативными заболеваниями, их количество превосходит реабсорбционную способность клеток канальцев, развивается перегрузка. Ярким примером является фенилкетонурия и фенилпировиноградная олигофрения, сопровождается нарушениями центральной нервной системы, глубокой умственной отсталостью, нарушением походки, гиперкинезами, «мышиным» запахом.
3. Вторичная – возникает на фоне других патологий. По количеству выделяемых кислот различают специфическую (одна кислота) и неспецифическую (несколько кислот) аминоацидурию.
Причины заболевания
Этиологоческими причинами развития почечной и предпочечной аминоацидурии являются генетически обусловленные ферментопатии: фенилкетонурия, гомоцистинурия, кетоацидурия, болезни Хартнупа.
Наследуются эти заболевания по аутосомно-рецессивному типу и все характеризуются генетической недостаточностью энзимов, участвующих в обмене веществ. Предрасполагающим фактором является наличие у обеих родителей поврежденной хромосомы, отвечающей за образование той или иной аминокислоты.
Вторичная аминоацидурия является следствием длительного воздействия на организм экзо- и эндогенных веществ:
· Отравление свинцом, медью, ураном, щавелевой кислотой.
· Болезнь Вильсона-Коновалова – гепатоцеребральная дистрофия.
· Нефротический и нефритический синдром.
· Синдром Дебре-Франкони – генерализованная патология проксимальных канальцев.
· Миеломная болезнь.
4. Патология конечного этапа белкового обмена
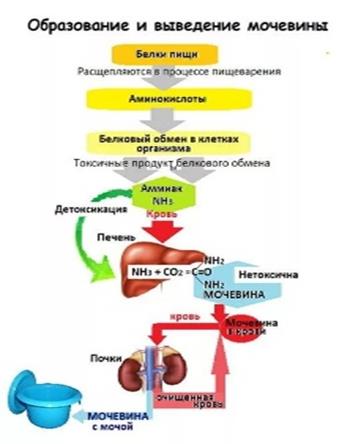
Схема: Патология конечного этапа белкового обмена
Основным конечными продуктами белкового обмена являются аммиак и мочевина. Аммиак токсичен, поэтому по мере образования его происходит связывание - мочевинообразование в печени. Патологией конечного этапа белкового обмена являются процессы образования аммиака и мочевины.
Гиперазотемия - повышение концентрации азота мочевины в крови в результатенарушения функции почек и избыточного поступления в кровь азотсодержащих веществ при усиленном белковом распаде.
Виды гиперазотемий:
1. Ретенционная гиперазотемия (при снижении уровня клубочковой фильтрации) может иметь почечное и внепочечное происхождение. Почечная ретенционная гиперазотемия развивается при заболеваниях почек, сопровождающихся поражением клубочкового и канальцевого аппарата. Внепочечная ретенционная (олигурическая) гиперазотемия может быть обусловлена уменьшением кровоснабжения почки вследствие поражения ее сосудов
Происходит увеличение содержания остаточного азотав крови происходит главным образом за счет азота креатинина, индикана, мочевины. Максимальная степень выраженности этого нарушения носит название уремии, которая может возникнуть при острой и хронической почечной недостаточности.
2. Продукционная гиперазотемия (при нормальной клубочковой фильтрации) наблюдается при усиленном распаде тканевых белков, что имеет место при кахексии, лейкозах, ранениях, инфекционных заболеваниях, а также после различных оперативных вмешательств. Нарушение функции гепатоцитов, независимо от генеза, сказывается на активности процессов дезаминирования аминокислот, что приводит к увеличению их количества в крови (в норме 2,9-4,3 mM) – аминоацидемии, сопровождающейся аминоацидурией.
3. Смешанная (комбинированная) форма гиперазотемии, при которой повышенный распад белка в тканях сочетается с недостаточным выведением азотистых продуктов с мочой. Конечными продуктами белкового обмена являются аммиак, мочевина, мочевая кислота, креатинин, индикан, СО 2, Н 2 О.
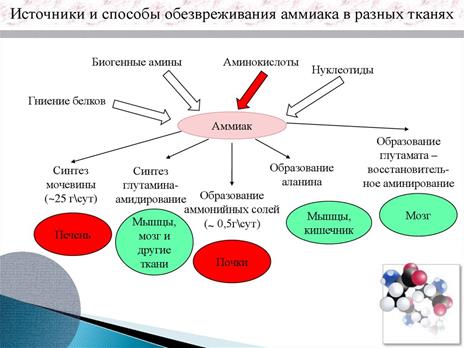
Схема: Источники и способы обеззараживания аммиака
МЕТОДЫ ИССЛЕДОВАНИЯ БЕЛКОВОГО ОБМЕНА
1. Общий белок.
Нормальная концентрация общего белка в крови: 65-85 г/л
Плазма крови человека в норме содержит более 100 видов белков. Примерно 90% общего белка составляют альбумины, иммуноглобулины, липопротеины, фибриноген, трансферрин; другие белки присутствуют в плазме в небольших количествах. Синтезируются в печени.
Понижение белка в крови (Гипопротеинемия) наблюдается при недостаточном потреблении белка с пищей — заболевания желудочно-кишечного тракта, сужение пищевода (опухоли), недоедание, полное или частичное голодание; снижении синтезабелка в печени — несбалансированный аминокислотный состав пищи, хронические паренхиматозные гепатиты, интоксикации, злокачественные новообразования, лечение кортикостероидами; при усиленном распаде белков — кахексия, тяжелые инфекции, длительные воспалительные; при потери белка — кровоизлияния, ожоги, острые и хронические кровотечения, нефротический синдром и гломерулонефриты.
Повышение белка в крови (Гиперпротеинемия) наблюдается при остром и хроническом воспалительном процессе; миеломной болезни, лимфогрануломатозе
Небольшое количество белка в суточной моче присутствует и у вполне здоровых лиц, однако в разовой порции мочи такие концентрации обычными методами не выявляются. Часть этих белков сывороточного происхождения, другая часть является продуктом мочевыводящих путей.
Протеинурия - обнаружение в моче белковчаще всего свидетельствует о заболеваниях почек с нарушением почечного фильтра. Принято подразделять протеинурию в зависимости от места возникновения:
1. Преренальная,связанная с усиленным распадом белков тканей или выраженным гемолизом;
2. Ренальная, обусловленная патологией клубочков или канальцев почек;
3. Постренальная, связанная с воспалением мочевыводящих путей.
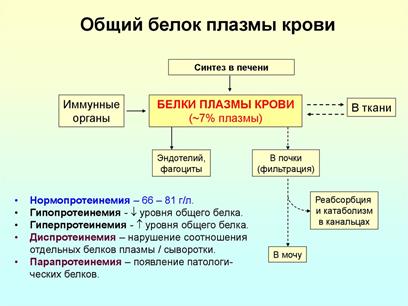




Белковые фракции.




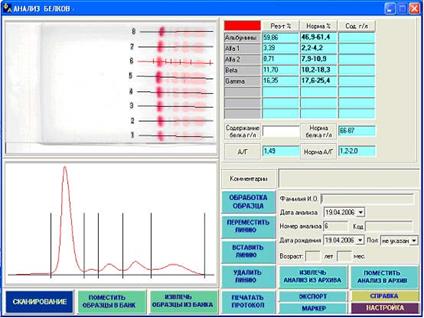
Гипопротеинемия и гиперпротеинемия диагностируются по показателям электрофореза – белковым фракциям. Методы фракционирования: Электрофоретическое фракционирование
1. Преальбумины. Нормальная концентрация преальбумина в крови: 0,18-0,38 г/л
Перед фракцией альбуминов при использовании метода радиальной иммунодиффузии обнаруживается белок, получивший название преальбумин. Содержит триптофан, синтезируется в печени и выполняет в основном транспортную функцию. В крови он ответственен за перенос ретинола, тироксина и трийодтиронина в ткани.
2. Альбумины. Нормальная концентрация альбуминов в крови: 30-50 г/л. Следующая по подвижности фракция — альбуминовая, эта фракция синтезируется почти исключительно в печени. Альбумины поддерживают коллоидно-осмотическое давление и выполняют транспортную функцию – связывание и перенос длинноцепочечных жирных кислот, пигментов (билирубин), катионов (например, Ca2+ и Mg2+), анионов (Cl–), желчных кислот, витаминов, гормонов (альдостерон, прогестерон, гидрокортизон)
3. Глобулины. Нормальная концентрация глобулинов в крови:
| α1-глобулины | 3-6% | 1-3 г/л |
| α2-глобулины | 9-15% | 6-10 г/л |
| β-глобулины | 8-18% | 7-11 г/л |
| γ-глобулины | 15-25% | 8-16 г/л |
Глобулин – это общий термин, который применяют для описания набора из шестидесяти белков, включая антитела (или гамма-глобулины) и белок-углеводные соединения, известные как гликопротеины. Существует четыре основные группы белков глобулинов, известных как альфа-1, альфа-2, бета- и гамма-протеины. На практике диагностически значимо только повышение уровня белковых фракций.
Увеличение фракции a – глобулиновпроисходит за счет белков острой фзыпри остром воспалительном процессе; увеличение b – глобулинов – за счет патологических белков - парапротеинов при миеломе, лимфогрануломатозе; увеличение γ – глобулинов – пза счет иммуноглобулинов IgA, IgM, IgG при хронических воспалительных процессах
Функции глобулинов:
1. Транспортная.Транспортируют липиды, при этом образуют с ними комплексы - липопротеины. Среди белков этой фракции есть белки, предназначенные для транспорта гормонов: тироксин-связывающий белок – перенос тироксина, транскортин – транспорт кортизола, кортикостерона и прогестерона, кислый гликопротеин – транспорт прогетерона.
2. Участие в функционировании системы свертывания крови и системы комплемента- протромбин.
3. Регуляторная функция. Некоторые белки фракции1-глобулинов яляются эндогенными ингибиторами протеолитических ферментов. Наиболее высока в плазме концентрация1-антитрипсина. Содержание его в плазме от 2 до 4 г/л (очень высокое), молекулярная масса - 58-59 кДа. Главная его функция - угнетение эластазы - фермента, гидролизующего эластин (один из основных белков соединительной ткани).1-антитрипсин также является ингибитором протеаз: тромбина, плазмина, трипсина, химотрипсина и некоторых ферментов системы свертывания крови. К фракции1-глобулинов относят также1-антихимотрипсин. Он угнетает химотрипсин и некоторые протеиназы форменных элементов крови.
2. Белки острой фазы воспаления
1. С‑реактивный белок (СРБ). Нормальная концентрация СРБ в крови: 68‑8200 мкг/л. Это белок острой фазы, повышение концентрации которых указывает на воспалительный процесс в организме. Данный белок нашел применение в клинической диагностике как индикатор воспаления (более чувствителен чем СОЭ). СРБ синтезируется печенью. Концентрация СРБ в крови повышается через 6 часов с момента начала воспалительной реакции. При наличии воспалительного процесса, практически любой этиологии, включая опухолевые и некротические процессы количество белка значительно повышается, именно поэтому СРБ считается неспецифическим маркером воспалительного ответа.Повышение реактивного белка в крови может быть ранним признаком инфекционного
процесса, особенно это касается бактериальных инфекций. Снижаетсяили совсем исчезает белок в стадию хронизации или выздоровления.
2. Тропонин.

Нормальная концентрация тропонина в крови: 0–0,028 нг/мл. Это особый белок, содержащийся только внутри клеток сердечной мышцы (кардиомиоцитах), он практически не определяется в крови при нормальных условиях. Однако если кардиомиоциты начинают гибнуть и разрушаться, а чаще всего это случается из-за развившегося инфаркта миокарда, то тропонин начинает проникать в общий кровоток, ввиду чего его концентрация в крови возрастает в сотни, а иногда и тысячи раз. Эта особенность и стала ключевым фактором, позволяющим диагностировать инфаркт миокарда.
Особенности тропонина.При инфаркте концентрация некоторых веществ в крови значительно повышается, например, таких как ЛДГ, АСТ, АЛТ, ГОТ, миоглобин и прочие. Повышение этих веществ наблюдается не только при инфаркте, но и при других состояниях, не имеющих никакого отношения к сердцу, в отличие от тропонина. Тропонину свойственно повышаться только в случае разрушения клеток сердечной мышцы, поэтому на сегодня он лучший лабораторный показатель для диагностики инфаркта миокарда. Через 3-4 часа от начала инфаркта уровень тропонина начинает превышать допустимые границы нормы. Тропонин будет сохраняться в кровотоке в повышенной концентрации как минимум 5-7 дней после инфаркта. Это позволяет диагностировать перенесенный инфаркт.
Количественный анализ – это определение концентрации тропонина в крови лабораторным методом, результатом которого является конкретная цифра.(0–0,028 нг/мл).
Качественный анализ проводится посредством помещения капли крови пациента на специальную тест полоску. В случае если тропонин превышает норму, то мы увидим это по тест-полоске. Это будет достаточно достоверным признаком гибели клеток сердечной мышцы.
3. Микроальбумин.
Моча на микроальбуминурию – показатель раннего поражения почек, который диагностирует начальные стадии патологии сосудов (эндотелиальной дисфункции, атеросклероза), и неизменно коррелирует с увеличением сердечно-сосудистой заболеваемости и смертности.
Микроальбуминурия – это выделение почками (путем клубочковой фильтрации) альбумина в количествах, определить которые с помощью рутинных лабораторных методов (клинический анализ мочи, например, путем осаждения сульфосалициловой кислотой) не удается - от 30 до 300 мг/сутки или от 20 до 200 мкг/минуту.
При отсутствии инфекции мочевыводящих путей и острого заболевания повышенная экскреция альбуминов с мочой, как правило, отражает патологию клубочкового аппарата почек. Чаще всего микроальбуминурия является признаком первичных или вторичных функциональных либо органических поражений тубулогломерулярного аппарата почек и свидетельствует о генерализованном поражении сосудистой системы и прогрессировании почечной недостаточности.
3. Характеристика гемоглобина
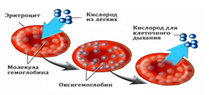
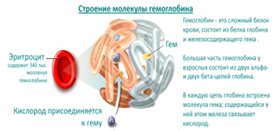
HGB (Hb, hemoglobin) — концентрация гемоглобина в цельной крови (норма 132—173 г/л). Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») — сложный железосодержащий белок, осуществляющий доставку кислорода из легких к тканям организма и возвращающий углекислый газ из тканей в легкие.
У человека гемоглобин находится в эритроцитах - красных кровяных тельцах, за пределами эритроцитов в норме он не обнаруживается. Не связанный с эритроцитами (в свободном состоянии) он высоко токсичен и вызывает острую почечную недостаточность.Синтезируется гемоглобин в эритроцитах, в костном мозге, когда те еще находятся в ядерной стадии (эритробласты и нормобласты).
Молекула гемоглобина представляет собой сложный протеин (хромопротеин), состоящий из четырех гемов и белка глобина. Гем, в центре которого находится двухвалентное железо (Fe2+), отвечает за связывание кислорода в легких.
Соединяясь с кислородом и превращаясь в оксигемоглобин (HHbO2), он немедленно доставляет тканям необходимый для дыхания компонент, а оттуда забирает углекислый газ, образуя карбогемоглобин (HHbCO2), чтобы транспортировать его в легкие. Оксигемоглобин и карбогемоглобин относятся к физиологическим соединениям гемоглобина.
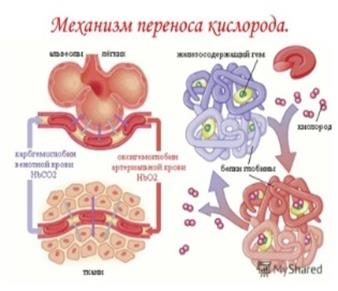
Функции гемоглобина:
- переносит кислород от лёгочных альвеол к тканям;
- транспортирует углекислый газ от тканей к лёгким;
- участвует в поддержании буферного кислотно-основного равновесия крови.
4. Белки, регулирующие образование гемоглобина
1.Ферритин. Нормальная концентрация ферритина в крови: 12-300 нг/мл. Ферритин - основной белок хранения железа в организме, поэтому определение содержания ферритина в сыворотке – косвенный способ измерения количества железа что хранится в организме.
Высокие уровни ферритина могут указывать на заболевание с нарушением хранения железа - гемохроматоз .Наследственный гемохроматоз - генетическое заболевание, при котором в организме накапливается избыточное железо (перегрузка железом). У людей с наследственным гемохроматозом ежедневное всасывание железа из кишечника больше, чем необходимо для возмещения потерь. Так как в норме организм не может выделить избыток железа, то поглощаемое железо накапливается в организме. Человек с гемохроматозом может накапливать до 20 грамм железа при норме 3-4 грамма. Избыток железа откладывается в суставах, печени, яичках и сердце. Отложения железа приводят к повреждению этих органов и вызывает признаки и симптомы гемохроматоза. Повышенный уровень ферритина характерен для острого лейкоза и воспалительных процессов:
Низкие уровни ферритина – показатели дефицита железа в организме. Без достаточного количества железа организм не может вырабатывать достаточного количества гемоглобина – компонента эритроцитов, переносчика кислорода. Развитие железодефицитной анемии является постепенным процессом. Если в ваш организм получает недостаточное количество железа, он в первую очередь использует железо, которое хранится в тканях (ферритин) и уровень ферритина в крови начнет уменьшаться. Если положение не исправить, запасы железа начинают истощаться, так как оно используется на образование эритроцитов. На ранней стадии дефицита железа, уровни железа в крови могут быть нормальными, но уровень ферритина начнет снижаться.
2. Трансферрин. Нормальная концентрация трансферрина в крови: 2,20-4,0 г/л.
Трансферрин синтезируется в печени и РЭС. Функции белка заключаются в связывании железа, превращении его в деионизированную форму и транспорте между тканями, в основном, между печенью и костным мозгом. Увеличениесодержания трансферрина отмечается при хронических железодефицитных анемиях различной этиологии. Снижение— при потерях белка: нефротический синдром и хроническая почечная недостаточность, гастроэнтеропатии, ожоги; злокачественные опухоли, анемии при хронических инфекциях, белководефицитные состояния, тяжелые заболевания печени, наследственные состояния.








