4.1.1. Определение клеточных маркеров методом розеткообразования
4.1.2 Определение клеточных маркеров методом мембранной иммунофлюоресценции
Принцип метода. Мембранная иммунофлуоресценция (МИФ) используется для локализации антигена (АГ) на интактной мембране. Для визуализации применяют специфические антитела (АТ), мечнные (конъюгированные) красителем, флуоресцирующим при облучении светом с адекватной длиной волны.
Разновидности метода:
- прямая МИФ – флуорохромные АТ связываются непосредственно с мембранными антигенами;
- непрямая МИФ (метод двойных антител) – на первом этапе с мембранными АГ связываются специфические немеченые АТ, на втором этапе с АТ связываются флуорохромные антивидовые АТ. Например антитела к g-глобулину кролика, если первые АТ были получены иммунизацией кроликов;
-непрямая МИФ, оба АТ флуорохромированы.
Способы учета результата МИФ:
1 Метод флюоресцентной микроскопии
2 Метод проточной цитофлуориметрии
4.1.3 Определение клеточных маркеров методом магнитной сепарации
Принцип метода. Методика определения уровня содержания в крови абсолютного количества лейкоцитов (популяций и субпопуляций лимфоцитов) основана на добавлении к образцу цельной крови частиц Dynabeads – моноклональных антител к необходимому лейкоцитарному антигену, иммуномагнитном выделении лейкоцитов из цельной крови, лизировании клеток, окрашивании выделенных ядер генцианвиолетом и подсчете окрашенных ядер на световом микроскопе.
Существуют два возможных варианта метода магнитной сепарации: негативное и позитивное выделение клеток.
4.1.3 Определение клеточных маркеров с использованием метода розеткообразования (Е-РОК и ЕАС-РОК)
Принцип метода Е-розеток. Т-лимфоциты обладают свойством образовывать розетки с эритроцитами барана. Рецептор эритроцитов барана рассматривают как маркер тимусзависимых лимфоцитов (Е-РОК: Erythrocyte — розеткообразующие клетки).
Принцип метода ЕАС-розеток. В-лимфоциты обладают свойством образовывать розетки с эритроцитами мыши. Метод ЕАС-розеток предназначен для выявления рецепторов к комплементу на поверхности мононуклеаров (лимфоциты, моноциты). Эритроциты, сенсибилизированные амборецептором антиэритроцитаркной сыворотки и нагруженные комплементом, связываются с мембраной мононуклеаров, содержащих рецепторы комплемента, с образованием розеток. Количество лимфоцитов, образующих ЕАС-розетки, частично коррелирует с количеством лимфоцитов, на поверхности которых обнаруживаются мембранные иммуноглобулины, то есть преимущественно с В-лимфоцитами.
За розетку принимают лимфоцит, окруженный тремя и более эритроцитами. Лимфоцит полностью окруженный эритроцитами, называется морулой.
4.2 Методы, используемые для определения клеточных показателей иммунитета (функциональные тесты)
4.2.1 Реакция бласттрансформации лимфоцитов
Принцип метода. Активация лимфоцитов под действием антигенов (митогенов), в результате чего наступает бласттрансформация клеток. Для стимуляции Т- и В-лимфоцитов используют различные митогены. Например, для стимуляции Т-лимфоцитов применяют ФГА и КонА и др., В-лимфоцитов – протеин А и др.
Под микроскопом в иммерсионной системе оценивают размеры лимфоцитов:
- малые лимфоциты (d клеток 7-7,5 мкм);
- бластоподобные переходные формы (d клеток 8-14 мкм);
- бласты (d клеток более 14 мкм).
4.2.2 Методика определения провокационных и кожных проб с предполагаемыми аллергенами.
Принцип метода. Метод основан на особенностях организма человека, заболевшего или переболевшего определенным инфекционным заболеванием (туляремией, бруцеллезом, туберкулезом и т.д.) отвечать местной аллергической реакцией, в виде гиперемии и инфильтрата, на введение спецефического антигена (тулярина, бруцеллина, туберкулина и т.д.).
Результат реакции оценивается через 48-72 часа (в соответствии с инструкцией по применению аллергена) путем измерения размера инфильтрата (папулы) в мм. Гиперемию учитывают только в случае отсутствия инфильтрата. Линейкой измеряют поперечный по отношению к предплечью размер инфильтрата.
При постановке реакции, например Манту, учет проводят следующим образом:
- отрицательная реакция – при полном отсутствии инфильтрата (папулы) и гиперемии или при наличии уколочной реакции (0-1 мм);
- сомнительная реакция – при инфильтрате размером 2-4 мм или только гиперемии любого размера без инфильтрата;
- положительная реакция – при наличии инфильтрата диаметром 5 мм и более;
- гиперергическая реакция – у детей и подростков считается реакция с диаметром инфильтрата 17 мм и более, у взрослых 21 мм и более, а также визикулонекротические реакции независимо от размера инфильтрации с лимфангоитом или без него.
К методам, используемым для определения функционального состояния клеток, относятся также цитотоксический тест, методы определения уровня продукции клетками цитокинов, интерферонов.
4.3 Методы, используемые для определения клеток, участвующих в реакции фагоцитоза
Скрининговые методы:
1 Оценка общего числа нейтрофилов (подсчет клеток с использованием метода микроскопии, геманализатора).
2 Исследование интенсивности поглощения микробов фагоцитами
(процент клеток-фагоцитов и средняя способность к поглащению каждого фагоцита) – ФАН.
3 Бактерицидность фагоцитов по НСТ-тесту.
Уточняющие методы:
1 Интенсивность хемотаксиса (миграции) фагоцитов.
2 Исследование адгезивной способности нейтрофилов к пластику и оценка числа клеток с адгезивными молекулами CD11/CD18 на мембране.
3 Реакция торможения миграции лейкоцитов.
Принцип метода определения ФАН. Определение фагоцитарной активности нейтрофилов основано на способности нейтрофилов поглощать и переваривать чужеродные частицы.
Оценку результатов исследований проводят методом микроскопии под иммерсией. Поглотительную способность клеток оценивают по двум показателям:
1 Фагоцитарному индексу Гамбургера – проценту фагоцитов, имеющих поглощённые частицы, от общего числа лейкоцитов;
ИФ = 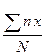 , где
, где
ИФ – индекс фагоцитоза;
n – число фагоцитировавших нейтрофилов;
х – число фагоцитированных частиц;
N – общее число просчитанных нейтрофилов
2 Фагоцитарному числу Райта (ФЧ) – среднему числу фагоцитированных частиц на один фагоцит.
Принцип метода НСТ. Основан на способности нейтрофилов поглощать нитросиний тетразолий и восстанавливать его в гранулы синего цвета нерастворимого диформазана. Восстановление НСТ обеспечивается энергией и продуктами окислительно-восстановительных реакций «метаболического взрыва, сопровождающих процесс фагоцитоза, а также повышением метаболизма активированного нейтрофила. Различают спонтанный и индуцированный НСТ-тест. Результаты спонтанного теста указывают на количество активированных клеток в крови больного. Результаты стимулированного теста дают представление о способности исследуемых нейтрофилов к активации in vitro.
Реакцию учитывали на световом микроскопе. Учёт результатов реакции проводят при подсчете 100 нейтрофилов. Вычисляют процент клеток, содержащих включения диформазана в виде гранул или сплошных отложений.
а) с нулевой активностью (гранул нет);
б) со слабо положительной реакцией (единичные гранулы);
с) с положительной реакцией (гранулы покрывают до 50% площади цитоплазмы);
д) с резко положительной реакцией (более 50% площади цитоплазмы занято гранулами).
Принцип метода оценки интенсивность хемотаксиса (миграции) фагоцитов. Лейкоциты обладают способностью направлено перемещаться под действием хемотаксического раздражения in vitro. В отсутствии такого раздражения лейкоциты движутся беспорядочно. Наличие такого раздражения приводит к тому, что они начинают перемещаться в одном направлении под влиянием веществ, вызывающих хемотаксис. Хемотоксическое ориентирование происходит под воздействием градиента концентрации. От хемотаксиса следует отличать усиленное, но ненаправленное движение клеток под влиянием некоторых веществ, содержащихся в окружающей среде. Хемотоксические факторы возникают in vitro при реакциях клеточного и гуморального иммунитета. Для изучения хемотаксиса Boyden предложил использовать микропористые фильтры. Метод основан на способности лейкоцитов проходить сквозь пористую мембрану в направлении градиента концентрации веществ, вызывающих хемотаксис.
Принцип метода оценки адгезивной способности нейтрофилов к пластику и оценка числа клеток с адгезивными молекулами CD 11/ CD 18 на мембране. Под воздействием провоспалительных цитокинов меняются адгезивные свойства как фагоцитов, так и клеток эндотелия В процессе движения нейтрофилов по сосуду часть из них образуют пристеночный пул. Контакты нейтрофилов с клетками эндотелия опосредуются адгезионными молекулами, относящимися к семейству селектинов. На лейкоцитах они представлены L-селектинами, на эндотелиальных клетках – это P- и E-селектины. Под действием провоспалительных цитокинов клетки эндотелия и нейтрофилов экспрессируют на своей поверности еще один класс адгезионных молекул, относящихся к семейству интегринов. Они и обеспечивают фазу прочной адгезии нейтрофилов. На нейтрофилах экспрессируются β2 интегрины, или CD11/CD18 рецепторы. Они представлены тремя адгезионными молекулами: CD11a/CD18, CD11b/CD18 и CD11c/CD18.
Принцип метода оценки реакции торможения миграции лейкоцитов.
Подвижность лейкоцитов периферической крови, их миграция к очагам тканевой деструкции, хемотаксис к ауто- и гетероантигенам, перераспределение между лимфоидными органами при стрессорно-адаптивных реакциях являются составляющей компонентой общей системы реактивности, способности к сохранению постоянства внутренней среды.
Сенсибилизированные к определенному антигену лимфоциты резко снижают скорость подвижности в среде, в которую вносят этот антиген. Реакция осуществляется при непосредственном взаимодействии антигенспецифических рецепторов лейкоцитов с антигеном, а также через воздействие фактора, ингибирующего миграцию клеток, выделяющегося при контакте со специфическим антигеном. Этот феномен позволяет продемонстрировать органоспецифическую клеточно-опосредованную гиперчувствительность.
Реакция торможения миграции лейкоцитов оценивают в агармиграционном и прямом капиллярном тесте.








