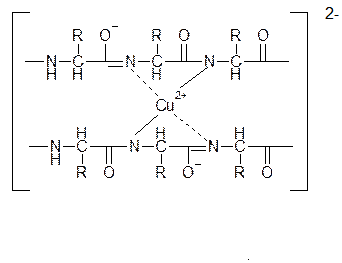Реакции, протекающие по карбоксильной группе.
Как карбоновые кислоты они образуют функциональные производные:
а) соли
H2N–CH2 H®–COOH + NaOH 2N–CH2–COO- Na+ + H2O
б) сложные эфиры
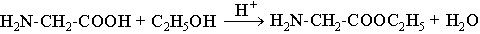
Для карбоксильной группы характерны реакции ацилирования: при взаимодействии со спиртами в присутствии сильных кислот образуются сложные эфиры: 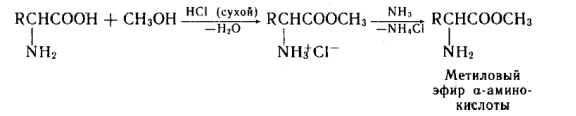
Таким образом, в кислой среде, когда аминогруппа блокирована протоном, аминокислоты выступаютацилирующим реагентом, т.е. донором ацильной группы, а в щелочной среде за счет свободной аминогруппы они выступают акцептором ацильной группы от сильного ацилирующего реагента, напрмер, хлорангидрида карбоновой кислоты, при этом образуются N- ацильные производные аминокислот.
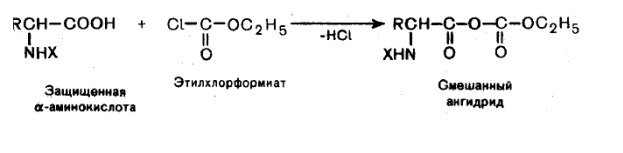
Образование галогенангидридов. При действии на аминокислоты с защищенной аминогруппой оксид-дихлоридом серы (хлористым тионилом) или оксид-трихлоридом фосфора образуются хлорангидриды защищенных аминокислот: 
Хлорангидриды аминокислот более реакционноспособны в реакциях нуклеофильного замещения, чем аминокислоты, например, в реакциях саммиаком :
R – CH(NH2) – COCl + NH3→ R – CH(NH2) – CONH2 + HCl
Эта реакция имеет важное значение для обезвреживания аммиака в клетке, образующегося в процессах дезаминирования аминокислот, аминов и амидов.
Декарбоксилирование – важный путь распада аминокислот в организме. В α-аминокислотах электроноакцепторная группа – NH3+ расположена в α-положении к группе – СОО-. Это вызывает сильную поляризацию связи между атомами углерода и способствует ее разрыву с образованием СО2, т.е. декарбоксилированию. В организме реакция катализируется декарбоксилазами, активность которых определяется пиридоксальфосфатом. В результате декарбоксилирования из α-аминокислот образуются биогенные амины:
R – CH(NH2) - COOH → RCH2 - NH2 + CO2
Аналогично происходит образование гистамина из гистидина, а из триптофана – триптамина и серотонина.
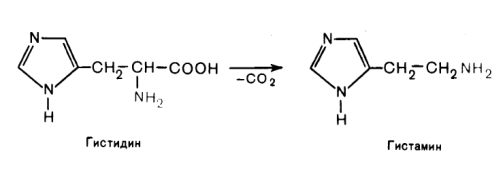
Гистаминобладает широким спектром физиологического действия: расширяет капилляры, ускоряет приток лейкоцитов в очаг воспаления, способствует активизации защитных сил организма, усиливает секрецию соляной кислоты в желудке, имеет прямое отношение к явлениям сенсибилизации и десенсибилизации, влияет на рецепторы сосудов, являясь нейромедиатором, участвует в болевом синдроме.
Реакции, протекающие по аминогруппе. Подобно аминам, аминокислоты реагируют с кислотами с образованием солей аммония:
H2N–CH2–COOH + HCl → [H3N–CH2–COOH]+Сl-
Реакция ацилирования протекает в слабощелочной среде, используется для защиты аминогруппы:
НООС – CH(R) –NH2 + R1 – COCl → HOOC – CH(R) – NH – CO –R1 + HCl
Реакция алкилирования (для защитыα-аминогруппы)
H2N – CH2–COOH + R1–Hal→ R1 –NH – CH2 – COOH +H-Hal
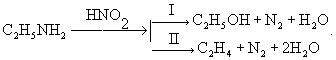
Реакция с азотистой кислотой. Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота — в гидроксикислоту:
H2N-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H2N-CH(R)-COOH + R'OH  H2N-CH(R)-COOR' + Н2О.
H2N-CH(R)-COOR' + Н2О.
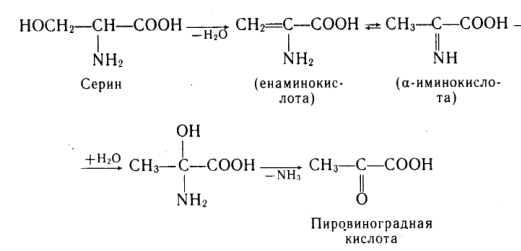
Элиминирование –путь трансформации аминокислот с функциональной группой в β-положении.
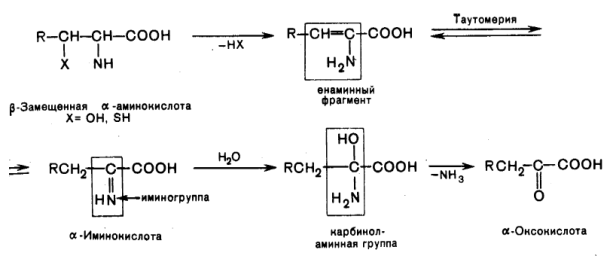
В организме протекает реакция элиминирования серина:
C альдегидами.С формальдегидом в слабощелочной среде аминокислоты легко переходят в моноанион, содержащий свободную аминогруппу, поэтому легко вступают в реакцию нуклеофильного присоединения к формальдегиду. При взаимодействии α-аминокислот с альдегидами образуются замещенные имины (основания Шиффа) через стадию образования карбиноламинов.
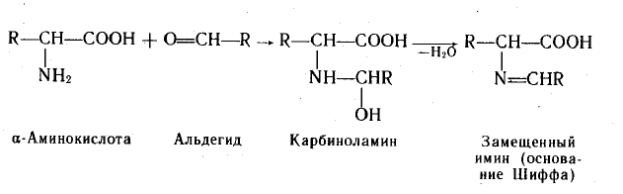
Амфотерный характер α –аминокислот не позволяет непосредственно проводить титрование их щелочью в аналитических целях. При взаимодействии аминокислот с формальдегидом получаются относительно устойчивые карбиноламины – N-метилольные производные, в которых наличие свободной карбоксильной группы позволяет провести титрование щелочью.
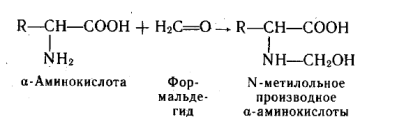
В таких производных аминокислот основность атома азота сильно понижена, что позволяет использовать эту реакцию для количественного определения α-аминокислот методом Серенсена. Способность аминогрупп в аминокислотах и белках взаимодействовать с формальдегидом приводит к необратимой денатурации белков. Этим объясняется высокая токсичность формальдегида и его стерилизующая способность.
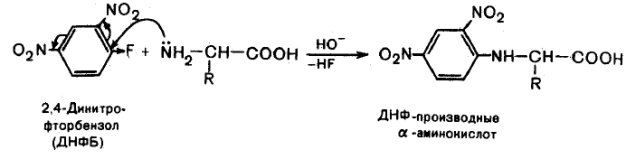
Образование ДНФ – производных. Αминокислоты образуют с 2,4-динитрофторбензолом окрашенные в желтый цвет динитрофенильные производные (ДНФ-производные), растворимые в органических растворителях. Они экстрагируются из реакционной смеси органическими растворителями и используются для идентификации хроматографическими методами.
Данная реакция протекает по механизму нуклеофильного замещения в бензольном кольце. Такое замещение становится возможным за счет влияния двух сильных электроноакцепторных нитрогрупп:
Образование ФТГ-производных (реакция Эдмана). Эта реакция широко используется при установлении строения пептидов. Взаимодействие аминокислот с фенилизотиоционатом протекает по механизму нуклеофильного присоединения. В образовавшемся продукте далее осуществляется внутримолекулярная реакция нуклеофильного замещения, приводящая к образованию циклического замещенного амида.
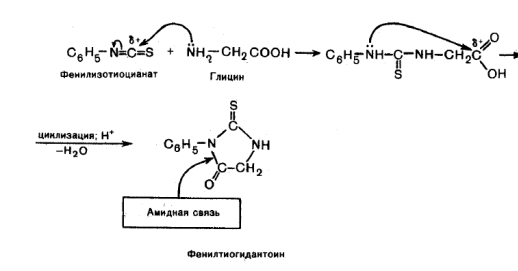
Циклические соединения, получаемые по данной реакции, представляют собой производные тиогидантоина, поэтому для них принято название фенилтиогидантоиновых производных (ФТГ – производных) α-аминокислот. Такие производные отличаются строением радикала R.
Дезаминирование, отщепление (элиминирование) аминогруппы (NH2) из органических соединений. Дезаминирование сопровождается замещением аминогруппы какой-либо др. группой (например, Н, ОН, OR, Hal) или образованием двойной связи. Дезаиминирование производят, в частности, действием на первичные амины азотистой кислотой. При этом из алифатических аминов образуются спирты (I) и олефины (II), например:
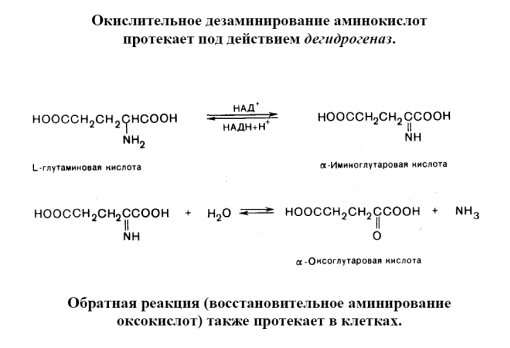
-кетокислот. Окислительному дезаминированию подвергаются также амины. Оксидазы природных аминокислот, кроме глутаматдегидрогеназы, дезаминирующей L-глутаминовую кислоту, в животных тканях мало активны. Поэтому большинство L-аминокислот подвергается непрямому дезаминированию путём предварительного переаминирования с образованием глутаминовой кислоты, которая затем претерпевает окислительное Ддезаминирование или др. превращения. Др. типы дезаминирования — восстановительное, гидролитическое (дезаминирование. аминопроизводных пуринов, пиримидинов и сахаров) и внутримолекулярное (дезаминирование. гистидина) — в большей степени распространены у микроорганизмов.aДезаминирование циклоалифатических аминов сопровождается расширением или сужением цикла. Ароматические амины дают с азотистой кислотой (в присутствии сильных неорганических кислот) диазония соли. Такие реакции, как гидролиз, гидрогенолиз, расщепление четвертичных аммониевых солей, пиролитические и др., также приводят к реакции дезаминитрования. Важную роль играет эта реакция в процессах жизнедеятельности животных, растений и микроорганизмов. Для α-aминокислот характерно окислительное дезаминирование. с образованием аммиака и
Внутримоекулярное дезаминирование
R–CH2 – CH(NH2)– COOH→ R–CH=CH–COOH + NH3
α,β – ненасыщенная кислота
Гидролитическое дезаминирование
R–CH(NH2) – COOH +H2O → R – CH(OH) – COOH + NH3
α - оксикислота
Окислительное дезаминирование
R-CH(NH2) – COOH +1/2 O2→ R –C(O) – COOH + NH3
α-кетокислота
Переаминирование, трансаминирование, обратимый перенос аминогруппы (—NH2) от аминокислот или аминов к оксокислотам:
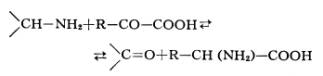
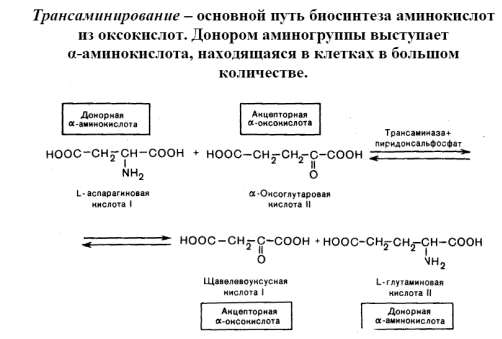
Реакция ферментативного переаминирования, открытая в 1937 советскими биохимиками А. Е. Браунштейном и М. Г. Крицман, играет роль важного промежуточного звена в процессах синтеза и дезаминирования многих аминокислот у животных, растений и микроорганизмов. Большинство природных аминокислот синтезируется в тканях путём переноса NH2-группы от глутаминовой кислоты — начального продукта усвоения азота — на различные оксокислоты. Обеспечивая быстрое взаимопревращение различных амино- и оксокислот, реакции переаминирования играют важную роль в регуляции и сопряжении обмена аминокислот и углеводов, ферменты переаминирования— аминотрансферазы имеются во всех живых клетках. Описано свыше 55 различных аминотрансфераз, катализирующих эту реакцию всех известных природных аминокислот и ряда биогенных аминов. Коферментом аминотрансфераз является производное витамина B6 — пиридоксальфосфат, играющий роль переносчика NH2-группы .Резкое повышение содержания некоторых аминотрансфераз в плазме крови больных служит диагностическим признаком при поражениях печени (гепатиты), сердца (инфаркт миокарда), мышц (травмы, миодистрофические заболевания).
Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция), так и принадлежащих разным молекулам (межмолекулярная реакция).
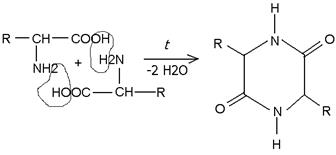
-аминокислоты образуют циклические дипептиды, называемыеaПри нагревании в сухом виде различные аминокислоты ведут себя по разному. Так, дикетопиперазинами:
-аминокислоты претерпеваютb дезаминирование:
СН3-СН2-СН(NH2)-CH2-COOH → СН3-СН=СН-CH2-COOH + NH3
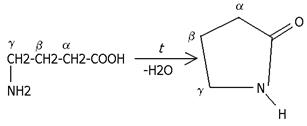
- аминокислоты превращаются в циклические внутримолекулярные пептиды-g лактамы:
-капролактам (полупродукт для получения капрона):e-аминокапроновой кислоты, в результате которого образуется eПрактическое значение имеет внутримолекулярное взаимодействие функциональных групп
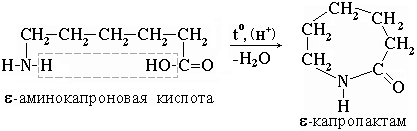
Образование комплексов с металлами.α-Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все α-аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
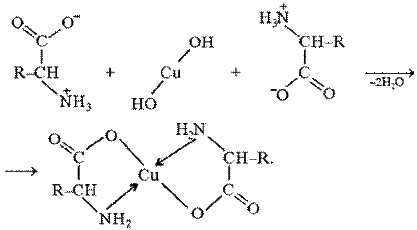
В таких солях ион меди координационными связями соединен с аминогруппами.
Реакционная способность радикала обусловлена наличием НО-, SH- групп или ароматичсеского ядра. Важнейшими из них являются окислительно-восстановительные реакции, β-декарбоксиилрование, диметилирование, переметилирование, которые ведут к переходу одних аминокислот в другие, что расширяет возможности синтеза различных аминокислот (например, окисление фенилаланина в тирозин).
При полном окислении тиоловой группы цистеин превращается в цистеиновую кислоту, которая декарбоксилируясь, превращается в таурин, образующий с желчными кислотами парные желчные кислоты (таурохолевую и тауродезоксихолевую).
HS – CH2-CH(NH2) – COOH + ½ O2→ HO3S – CH2 – CH(NH2) - COOH→
цистеин цистеиновая кислота
→CO2 + H2N – CH2 – CH2 –SO3H
таурин
Вопрос 5.Строение пептидной связи. Лактам-лактимная таутомерия.
-аминокислот образуется дипептид.a-аминокислот приводит к образованию пептидов. При взаимодействии двух aМежмолекулярное взаимодействие
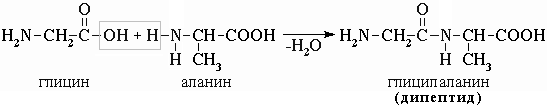
-аминокислот приводит к образованию трипептида и т.д.aМежмолекулярное взаимодействие трех
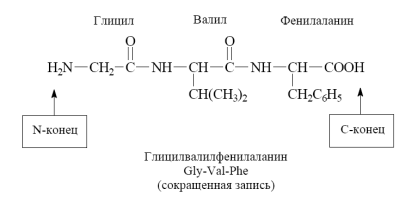
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью.
Многие растения и бактерии могут синтезировать все необходимые им аминокислоты из простых неорганических соединений. Большинство аминокислот синтезируются в теле человека и животных из обычных безазотистых продуктов обмена веществ и усвояемого азота. Однако, как уже говорилось ранее, валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин - являются незаменимыми, т. е. не могут синтезироваться в организме животных и человека, и должны доставляться с пищей. Суточная потребность взрослого человека в каждой из незаменимых аминокислот составляет в среднем около 1 г. При недостатке этих веществ (чаще триптофана, лизина, метионина) или в случае отсутствия в пище хотя бы одной из них невозможен синтез белков и многих др. биологически важных веществ, необходимых для жизни. Гистидин и аргинин синтезируются в животном организме, но лишь в ограниченной, иногда недостаточной, мере. Цистеин и тирозин образуются лишь из своих предшественников — соответственно метионина и фенилаланина — и могут стать незаменимыми при недостатке этих аминокислот. Некоторые аминокислоты могут синтезироваться в животном организме из безазотистых предшественников при помощи процесса переаминирования, т. е. переноса аминогруппы с одной аминокислоты на другую. В организме аминокислоты постоянно используются для синтеза и ресинтеза белков и др. веществ — гормонов, аминов, алкалоидов, коферментов, пигментов и др. Избыток аминокислот подвергается распаду до конечных продуктов обмена (у человека и млекопитающих до мочевины, двуокиси углерода и воды), при котором выделяется энергия, необходимая организму для процессов жизнедеятельности. Промежуточным этапом такого распада является обычно дезаминирование (чаще всего окислительное).
Существует целый ряд методов получения аминокислот вне организма (in vitro). Наибольшее применение находят получение из оксинитрилов (синтез Штекера) и карбоновых кислот.
1. Синтез Штекера заключается в том, что к альдегиду прибавляют аммиак и цианистый водород, образующийся α – аминонитрил гидролизуют водной кислотой:
R–CHO + HCN + NH3→ R–CH(NH2)–CN + H3O+→ R–CH(NH2) – COOH
Получение аминокислот из карбоновых кислот включает две стадии: бромирование карбоновой кислоты и последующую обработку α – бромпроизводного избытком аммиака:
R-CH2-COOH + Br2→ R-CH(Br)-COOH +NH3→ R-CH(NH2)-COOH
2. Получить аминокислоты возможно, например действием аммиака на галогензамещённые карбоновые кислоты:
R-CH(CI)COOH+2NH3 → RCH(NH2 )COOH + NH4CI,
3. Восстановлением оксимов или гидразонов, кето- или альдегидокислот:
R-C(= NOH)-COOH → R-CH(NH2 )-COOH
4. Замещением галогена на аминогруппу в соответствующих галогензамещенных кислотах:
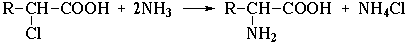
5. Присоединением аммиака к α, β-непредельным кислотам с образованием β - аминокислот:
CH2=CH–COOH + NH3 →H2N–CH2–CH2–COOH
6. Некоторые аминокислоты выделяют из продуктов гидролиза богатых ими белков методом адсорбции на ионообменных смолах; так выделяют глутаминовую кислоту из казеина и клейковины злаков; тирозин — из фиброина шёлка; аргинин — из желатины; гистидиниз белков крови. Некоторые аминокислоты производят синтетически, например метионин, лизин и глутаминовую кислоту. Аминокислоты получают в больших количествах также микробиологическим синтезом. Поступление в организм незаменимых аминокислот определяется количеством и аминокислотным составом пищевых белков. Это следует учитывать для организации правильного общественного питания и составления рационов для разных возрастных и профессиональных групп населения. Потребность в пищевом белке может быть полностью покрыта за счёт смеси аминокислот. Этим пользуются в лечебном питании.
7. В организме (in vivo) заменимые аминокислоты синтезируются из α-кетокислот путем восстановительного аминирования или трансаминирования с аминокислотой.
Белки, протеины, высокомолекулярные природные органические вещества, построенные из аминокислот и играющие фундаментальную роль в структуре и жизнедеятельности организмов. Название "протеины" (от греч. protos – первый, важнейший) более точно отражает первостепенное биологическое значение этого класса веществ, хотя в отечественной литературе их принято называть белками или белковыми веществами по аналогии с белком куриного яйца, приобретающего при кипячении (денатурации) белый цвет.В природе существует примерно 1010-1012 различных белков, обеспечивающих жизнедеятельность организмов всех степеней сложности от вирусов до человека. Это мускулы, кровь, сердце, кожа, кости... Белками являются ферменты, антитела, многие гормоны и другие биологические активные вещества. Необходимость постоянного обновления белков лежит в основе обмена веществ. Именно белки (ферменты и др.) осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями. Белки входят в состав сложных клеточных структур — органелл. И хотя органеллы содержат также другие вещества (липиды, углеводы, нуклеиновые кислоты, неорганические компоненты), белки особенно важны; они — основные структурообразователи и играют ведущую роль в выполнении физиологических функций. Например, благодаря соответствующей организации различного рода белков биологические мембраны, покрывающие клетки, активно (с затратой энергии) переносят в клетку или из клетки определённые молекулы и ионы. В частности, транспорт катионов создаёт электрическую поляризацию, необходимую для процессов возбуждения. В двигательных аппаратах — мышечных волокнах и других — комплексы специфических белки осуществляют сокращение, превращая химическую энергию в механическую работу. Деятельность белков во многом связана с разными небелковыми веществами, из которых наибольшее биологическое значение имеют нуклеиновые кислоты. Однако решающим фактором молекулярных механизмов всех активных проявлений жизнедеятельности являются белки. В этом смысле подтверждено и детализировано известное положение Ф. Энгельса о белке, как основе биологической формы движения материи. Молекулы белков в структурном отношении бесконечно разнообразны — жёсткость и точность уникальной организации сочетаются в них с гибкостью и пластичностью. Всё это создаёт необозримые функциональные возможности; поэтому белки и явились тем исключительным материалом, который послужил основой возникновения жизни на Земле. Белки — один из основных продуктов питания человека и животных, они служат источником восстановления и обновления цитоплазмы клеток, образования ферментов, гормонов и др.
Как уже отмечалось выше, благодаря пептидным связям аминокислоты образуют белки. Молекула белка построена из 100 или более остатков аминокислот, ковалентно связанных в полимерные цепи. В человеческом организме 5 миллионов белков, причем ни один из белков человека не идентичен с белком любого другого живого организма. Часть белков образует комплексы с молекулами, содержащими серу, фосфор, железо, цинк и медь. Молекулярная масса белковых цепей колеблется от нескольких тысяч до нескольких миллионов (в вирусе табачной мозаики – около 40 000 000 молекул); в их состав входят сотни (иногда – сотни тысяч) аминокислотных остатков. Потенциально многообразие белков очень велико – каждому белку соответствует своя особая последовательность аминокислот, контролируемая генетически. На долю белков приходится около половины сухой массы клетки. Несмотря на такое разнообразие белковых структур для их построения необходимы всего 22 аминокислоты, 9 из которых незаменимы, то есть должны поступать с пищей человека, они не синтезируются в организме человека, остальные аминокислоты могут образовываться в нашем организме из других аминокислот. Таким образом, необходимо обеспечить адекватную поставку организму этих аминокислот соответствующим питанием с хорошо сбалансированным составом животных и растительных белков. Большинство растительных белков, даже очень важных, содержит лишь незначительное число незаменимых аминокислот – именно поэтому строгие вегетарианцы (не потребляющие даже яиц и молочных продуктов) могут испытывать дефицит данных аминокислот. Невозможно переоценить важность сбалансированного питания для обеспечения достаточного уровня всех незаменимых аминокислот.
Классификация белков
Классификация белков крайне затруднена их многообразием и сложностью молекул. К простым белкам, состоящим только из аминокислот, относят альбумины(яичный альбумин и сывороточный альбумин крови), глобулины (антитела в крови, фибрин), гистоны, склеропротеины (кератин волос, кожи и перьев, коллаген сухожилий, эластин связок).
К сложным белкам относятся белки, имеющие самое разнообразное назначение в организме: металлопротеины, липопротеины, гликопротеины, фосфопротеины и др. Небелковой частью молекул металлопротеинов являются ионы различных металлов, к-рые нельзя удалить из молекулы белка, не повредив ее белковую часть. Металлопротеинами являются многие ферменты, содержащие железо (цитохромы, каталаза), медь (тирозиназа), цинк (алкогольдегидрогеназа), а также дыхательные пигменты, в т. ч. гемоглобин, миоглобин и др. Липопротеины представляют собой хим. комплексы белков с липидами. Липопротеины выполняют важнейшую функцию депонирования и транспорта липидов, являются необходимой составной частью клеточных мембран. Концентрация разных липопротеинов в сыворотке крови служит диагностическим признаком ряда заболеваний (атеросклероза, ожирения и др.). Белки, в которых небелковая часть представлена углеводами (или углеводом), называют гликопротеинами. Гликопротеинами являются некоторые ферменты и гормоны, антитела и другие физиологически активные белки. Полагают, что специфическая активность этих соединений определяется именно углеводной частью их молекул. Сложные белки, молекулы которых содержат остатки фосфорной кислоты, присоединенные чаще всего к остатку аминокислоты серина (реже – треонина) в полипептидной цепи белка, называются фосфопротеинами, эти белки играют важную роль в клеточном метаболизме. К фосфопротеинам относятся белки биологических мембран и клеточных ядер, казеины и др. Присоединение остатков фосфорной кислоты (фосфорилирование) к пяти аминокислотным остаткам (серина и треонина) на С-конце полипептидной цепи зрительного белка родопсина и превращение его в фосфопротеин играет существенную роль в регуляции адаптации зрения к свету и к темноте. Превращение важнейших белков мозга в фосфопротеины в результате фосфорилирования происходит при стимуляции нервов или при действии на нервы определенных нейромедиаторов.
По структуре белки делятся на фибриллярные (третичная структура почти не выражена, нерастворимы, представляют собой длинные полипептидные цепи), глобулярные (третичная структура хорошо выражена, растворимы) и промежуточные(фибриллярные, но растворимые). Первые входят в состав соединительных тканей, вторые играют роль ферментов, гормонов, антител.
Функционально белки могут быть структурными(компоненты соединительных тканей, слизистых секретов), транспортными (перенос крови, липидов), защитными (антитела, тромбообразование),сократительными (в мышечных тканях),запасными (молоко, белок), ферментами, гормонами, токсинами (змеиный яд).
Функции белков
Белки выполняют множество самых разнообразных функций, характерных для живых организмов. Здесь будут перечислены главные и в некотором смысле уникальные для жизнедеятельности человека функции, не свойственные или лишь частично присущие другим классам биополимеров.
· Каталитическая функция белков. Все до сих пор открытые биологические катализаторы –ферменты являются белками. Эта функция белков является уникальной, не свойственной другим полимерным молекулам.
· Питательная (резервная) функция белков. К таким белкам относятся так называемые резервные белки, являющиеся источниками питания для развития плода; белки яйца (овальбумины) и основной белок молока (казеин) также выполняют главным образом питательную функцию. Ряд других белков, несомненно, используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы обмена веществ.
· Транспортная функция белков. Дыхательная функция крови, в частности перенос кислорода, целиком осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином A и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени.
· Защитная функция белков. Основную функцию защиты в организме выполняет иммунологическая система, которая обеспечивает синтез специфических защитных белков – антител в ответ на поступление в организм бактерий, токсинов или вирусов. Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу белок – белковое взаимодействие способствует нейтрализации их биологического действия и сохранению нормального состояния. В качестве другого примера защитной роли можно привести способность ряда белков крови к свертыванию. Свертывание белка плазмы крови фибриногена приводит к образованию сгустка крови, что предохраняет от потери крови при ранениях.
· Сократительная функция белков. В акте мышечного сокращения и расслабления участвует множество белковых веществ тела. Однако главную роль в этих жизненно важных процессах играют актин и миозин – специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам ряда субклеточных структур, что обеспечивает тончайшие процессы жизнедеятельности клеток.
· Структурная функция белков. Данная функция белков многопланова. Белки со структурными функциями занимают по количеству первое место среди других белков тела человека. Широко распространены такие важные структурные белки, как коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Не менее важную роль выполняют белки в комплексе с углеводами в формировании ряда секретов – мукоидов, муцинов и т.д. Наконец, в комплексе с липидами (в частности, фосфолипидами) белки участвуют в образовании биомембран клеток.
· Гормональная функция белков. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, вырабатываемые в железах внутренней секреции. Ряд гормонов представлен белками или полипептидами, например, гормоны гипофиза, поджелудочной железы и др.
Можно указать еще на некоторые другие жизненно важные функции белков, в частности, на способность белков к сохранению онкотического давления в клетках и в крови, на буферные свойства белков, регулирующие физиологическое значение pH внутренней среды, и др.
Молекулы белков имеют массу от десятков тыс. до 1 млн. и выше. Так, фермент рибонуклеаза имеет молекулярную массу 12 700, дыхательный пигмент улитки гемоцианин — 6 600 000. Элементарный состав большинства белков: 50,6—54,5% углерода, 6,5—7,3% водорода, 21,5—23,5% кислорода, 15—17,6%азота, 0,3—2,5% серы; в состав ряда белков входит и фосфор. Сведения о молекулярной массе и ряде свойств молекул белка можно получить, исследуя их осаждение (седиментацию) в ультрацентрифуге, диффузию, вязкость, растворимость и светорассеяние. Все белки с очень большой молекулярной массой построены из более мелких частиц — субъединиц. Растворимые белки — гидрофильные коллоиды, активно связывающие воду; их растворы обладают значительной вязкостью, низким осмотическим давлением. Молекулы белков не проходят через полупроницаемые мембраны, обладают слабой способностью к диффузии. Белки — амфотерные электролиты,т.к. имеют свободные карбоксильные (кислотные) и аминные (основные) группы. Изоэлектрическая точка различных белков неодинакова: для альбумина плазмы крови она равна 4,7, для зеина кукурузы 6,2. Белки имеют электрический заряд, изменяющийся в зависимости от структуры и реакции среды. В электрическом поле растворённые белки движутся (электрофорез), причём направление и скорость движения их неодинаковы. Растворимость белков варьирует не меньше, чем другие их свойства. Одни из них легко растворяются в воде, другие требуют для растворения небольших концентраций солей, третьи переходят в раствор только под воздействием сильных щелочей и т.п. Из растворов белки неодинаково осаждаются органическими веществами (например, спиртами) или высокими концентрациями солей (высаливаются). Существенные различия в растворимости и других свойствах используются при выделении индивидуальных белков из тех сложных систем, в которых они встречаются в природе. После очистки многие белки способны кристаллизоваться.
Структура белка
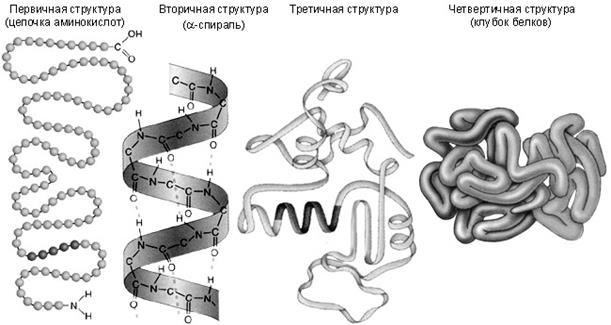
Каждому белку свойственна особая геометрическая структура. При описании пространственной структуры обычно описывают четыре разных уровня организации.
Под первичной структурой белка обычно понимают последовательность аминокислот. Первичная структура инсулина была открыта Ф. Сэнгером в 1944–54 годах; в настоящее время известна первичная структура нескольких сотен белков. Последовательность аминокислот определяет биологическую функцию белка, и замена одной единственной аминокислоты может резко изменить эту функцию. В молекулах белков аминокислоты соединены между собой пептидными связями (—СО—NH—) в линейной последовательности составляющей так называемую первичную структуру белка.
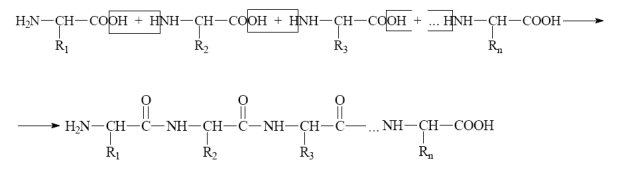
Для каждого белка не только состав, но и последовательность аминокислот в полипептидной цепи —первичная структура — строго индивидуальны; любое звено цепи — вполне определённая аминокислота. Все многочисленные виды белков, существующие в природе, различаются по первичной структуре; потенциально возможное их число практически неограниченно. Каждый из бесчисленного множества существующих белков имеет особую наследственно детерминированную первичную структуру, присущую только ему. Индивидуальная первичная структура каждого белка сохраняется в поколениях благодаря точной передаче соответствующей наследственной информации. Это обусловливает строго индивидуальную систему внутримолекулярных связей, т. е. уникальную конформацию белка. Для анализа первичной структуры белков разработаны специальные методы. Каждый белок характеризуется собственной «химической топографией» и своеобразными сочетаниями пространственно сближенных химических групп. Часть таких сочетаний служит функциональными центрами молекул. Благодаря структурному соответствию, напоминающему отношение ключа к замку (комплементарности), функциональные центры «узнают» и избирательно присоединяют вещества, на которые соответствующие белки «установлены». Функциональные — активные центры белков-ферментов специфически присоединяют субстраты и активируют их, ускоряя и направляя химические превращения. Например, при переваривании определёнными ферментами, например трипсином, каждый белок даёт свой набор фрагментов (пептидов). При соответствующем их разделении на листе бумаги получается «пептидная карта», которая, подобно отпечатку пальца, характерна для данного белка. Разделение на пептиды и определение строения каждого из них в отдельности — основной путь расшифровки первичной структуры белка.
Пространственная конфигурация (конформация) полипептидной цепи определяется первичной структурой и условиями среды. При обычных условиях (температура не выше 40°С, нормальное давление и т.д.) белки характеризуются внутримолекулярной упорядоченностью. «Хребет» полипептидной цепи местами может закручиваться спиралью или образовывать полностью вытянутые отрезки. Обычно белковая молекула имеет форму спирали. Это так называемая вторичная структура, стабилизируемая водородными связями, возникающими между CO- и NH-группами. На один виток спирали приходится 3,6 аминокислотного остатка. Существуют и другие формы вторичной структуры, например, тройная спираль коллагена и складчатый слой фибрина.
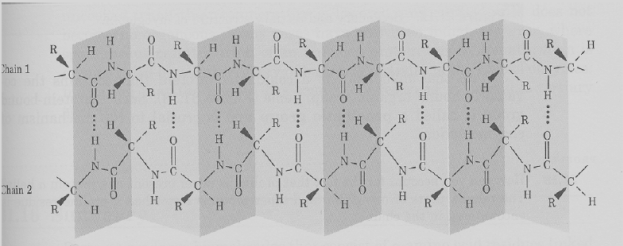
Аминокислотные (полипептидные) цепи, содержащие аминокислоту цистин, в местах его расположения скреплены дисульфидными связями (—S—S—). Кроме пептидных и дисульфидных связей, в молекуле белка есть многочисленные связи с меньшей энергией взаимодействия, имеющие большое значение для внутренней организации и функционирования. Среди этих связей наиболее существенны так называемые гидрофобные связи, создаваемые неполярными боковыми группами аминокислот. Эти группы, лишённые сродства к воде, имеют тенденцию контактировать между собой внутри молекулы. Кроме того, в молекуле белка можно выделить также электростатические взаимодействия между группами, несущими электрические заряды.
Дисульфидные, ионные и водородные связи, а также гидрофобное взаимодействие заставляют большинство белковых цепей сворачиваться в компактнуюглобулу. Полипептидная цепь в целом «упаковывается» и жестко фиксируется с помощью взаимодействий боковых групп аминокислот. Это так называемая третичная структура белка. В зависимости от укладки полипептидных цепей форма молекул варьирует от фибриллярной (вытянутой, нитеобразной) до глобулярной (округлой).
Наконец, многие белки с особо сложным строением состоят из нескольких полипептидных цепей – способ их упаковки называется четвертичной структурой.При помощи особых центров взаимного связывания («контактных площадок») определённые белки соединяются по нескольку вместе (структура 4-го порядка) или создают значительно более сложные системы.
Конформация некоторых белков раскрыта рентгеноструктурными исследованиями. Создание упорядоченной прочной конформации белка определяется целыми системами взаимодействий, находящихся во взаимной зависимости. Смены конформации белка, вызываемые изменениями среды или реакциями, в которые они вступают, связаны с изменением ряда взаимодействий. Конформационные переходы охватывают молекулу целиком или ограничиваются определёнными районами. При нагревании, резком подкислении среды и других сильных воздействиях происходит «плавление» молекулы белка — переход в состояние беспорядочного клубка. Молекула временно или постоянно теряет свою третичную структуру и «сворачивается» или выпадает в осадок. Использование спирта в качестве дезинфецирующего средства связано именно с тем, что он вызывает денатурацию белка любых бактерий. Это, как правило, влечёт за собой ряд других превращений, общий результат которых обозначают как денатурациюбелка.При этом понижается растворимость, усиливается вязкость их растворов, теряются ферментативные и другие биологические свойства.
Изучение структуры белка даёт возможность переходить к их синтезу. В 1955 была выяснена структура инсулина, молекула которого состоит из двух сравнительно коротких полипептидных цепей (21 и 30 аминокислотных остатков). Вслед за этим была раскрыта первичная структура гемоглобина,рибонуклеазы, трипсина и ряда других белков. Путём химического синтеза сначала были получены сложные пептиды со свойствами гормонов, затем удалось синтезировать гормон инсулин, наконец — фермент рибонуклеазу. Правильность химической формулы инсулина и рибонуклеазы подтвердилась тем, что синтетические белки не отличались от молекул, продуцируемых организмом, ни по физико-химическим свойствам, ни по биологической активности. Установлена полностью или частично первичная структура свыше 200 Б.
Биосинтез белка— процесс образования белков из аминокислот в клетках живых организмов. Выяснение механизма этого процесса, имеющего огромное биологическое значение, можно отнести к важнейшим достижениям науки 20 в. Биосинтез белка идёт при помощи особых сложных механизмов, обеспечивающих упорядоченное воспроизведение специфической уникальной структуры. Механизмы эти едины или весьма сходны для самых разнообразных клеток и организмов, в них принимают участие нуклеиновые кислоты, в особенности рибонуклеиновые кислоты (РНК). Этот процесс идёт с использованием энергии, накопленной в виде аденозинтрифосфорной кислоты (АТФ). Биосинтез белка происходит на особых рибонуклеопротеидных частицах — рибосомах, состоящих из почти равных количеств рибосомной РНК (р-РНК) и белков. Первичная структура (последовательность аминокислот) синтезирующихся полипептидных цепочек обеспечивается соединением с рибосомами особой матричной, или информационной, рибонуклеиновой кислоты (и-РНК, или м-РНК), которая содержит информацию о специфическом строении белка, «закодированную» в виде последовательного расположения нуклеотидов, составляющих и-РНК. Эту информацию и-РНК получает от дезоксирибонуклеиновой кислоты (ДНК), хранящей и передающей её по наследству. Аминокислоты, прежде чем попасть в рибосомы, активируются, получая энергию от АТФ и образуя соединение с адениловой кислотой. (Активированные аминокислоты представляют собой смешанный ангидрид аминокислоты и адениловой кислоты — аминоациладенилат.) Далее, остаток данной аминокислоты переносится на соответствующую транспортную рибонуклеиновую кислоту (т-РНК). Оба эти процесса катализируются одним и тем же ферментом (аминоациладенилатсинтетазой, или аминоацилт-РНК-синтетазой), специфическим для каждой аминокислоты. Определённой аминокислоте соответствуют одна или несколько специфичных для неё т-РНК. Все т-РНК сравнительно низкополимерны, содержат около 80 нуклеотидных остатков. Они построены по общему плану: в начале цепи находится 5-гуаниловая кислота, а в конце — часто обменивающаяся группировка из двух остатков цитидиловой кислоты и аденозина, к которому и присоединяется остаток аминокислоты. Остаток аминокислоты, соединённый с т-РНК, далее переносится на рибосомы, где и происходит образование полипептидной цепочки . Т. о., рибосомная стадия — центральный этап биосинтеза белка. В процессе биосинтеза рибосомы соединяются в цепочки при помощи и-РНК, образуя активные белоксинтезирующие структуры – полирибосомы, или полисомы.
и-РНК синтезируется на матрице ДНК. В уникальной последовательности нуклеотидов ДНК линейно «записана» генетическая информация о последовательности аминокислотных остатков в полипептидных цепочках белка. В новообразованной и-РНК получается нуклеотидная последовательность, соответствующая матричной ДНК, — комплементарная последовательность, которая определяет первичную структуру синтезирующейся полипептидной цепочки. Включение каждой аминокислоты обусловливается (кодируется) определёнными группами из трёх нуклеотидных остатков (триплетами). Каждой аминокислоте соответствует несколько триплетов, или кодонов, для которых теперь установлены состав и последовательность нуклеотидов.
В полисомах т-РНК, нагруженная аминокислотой, присоединяется к соответствующим кодонам и-РНК. Это присоединение совершается внутри рибосомы в силу взаимодействия комплементарных оснований: аденина с урацилом или тимином и гуанина с цитозином. При этом т-РНК присоединяется к кодону содержащимся в ней комплементарным триплетом, называемым антикодоном. По мере продвижения рибосомы по нуклеотидной цепочке и-РНК к соседним кодонам присоединяются новые молекулы т-РНК, нагруженные аминокислотами. Предыдущая т-РНК при этом освобождается, присоединяя свою аминокислоту карбоксильным концом к аминогруппе новой аминокислоты с образованием пептидной связи. Т. о., полипептидная цепочка растет по мере продвижения рибосомы по и-РНК и освобождается по завершении своего синтеза, пройдя соответствующий участок и-РНК, комплементарный данному структурному гену ДНК.
Процесс биосинтеза белка не исчерпывается образованием полипептидных цепочек, т. е. созданием первичной структуры. Далее происходит свёртывание цепочек в спирали, их «укладка» и взаимодействие, и образование вторичной, третичной и, иногда, четвертичной структуры.
В связи с важным значением белка разрабатываются новые методы получения белков и аминокислот путём промышленного микробиологического синтеза, т. е. выращиванием микробов (например, дрожжей и др.) на дешёвом сырье (например, нефти, газе и др.).
Аминокислотный состав устанавливается путем гидролиза белка с последующим хроматографическим анализом. Амидные связи способны гидролизоваться как в кислой, так и в щелочной средах. Гидролиз может быть частичным (образуются более короткие полипептиды и пептиды) или полным (образуется смесь аминокислот). Широко используют частичный гидролиз под действием ферментов петитаз, которые избирательно гидролизуют пептидные связи внутри белковой молекулы (эндопептитазы), либо на конце цепи (экзопептитазы).
Полученную в результате гидролиза смесь аминокислот анализируют в аминокислотном анализаторе. Таким образом определяется аминокислотный состав белков.
Более сложным является определение аминокислотной последовательности, т.е. первичной структуры белка. Первичная структура определяется путем последовательного отщепления аминокислот от одного из концов цепи и их идентификация. Первый способ отщепления и идентификации N-концевой аминокислоты был предложен Сенгером (1945), в котором белок обрабатывали динитрофторбензолом, а затем гидролизовали. Более простым, а поэтому и более распространенным методом определения первичной структуры белка, является метод ступенчатой деструкции Эдмана (фенилтиогидрантоиновый). Преимущество этого метода заключается в том, что он позволяет сохранить часть молекулы, от которой была отщеплена аминокислота. Также широко известен и дансильный метод, который основан на взаимодействии N-концевой аминокислоты с дансилхлоридом.
В настоящее время для определения аминокислотного состава белков используют специальные приборы –секвенатры, работающие в автоматическом режиме.
Аминокислоты можно обнаружить с помощью цветных реакций: нингидриновой, ксантопротеиновой, Фоля, Милона, биуретовой пробы и др. Эти реакции неспецифичны, т.к. основаны на обнаружении отдельных фрагментов в структуре аминокислот, которые могут встречаться и в других соединениях.
Нингидриновая реакция, цветная реакция, применяемая для качественного и количественного определения аминокислот, иминокислот и аминов. При нагревании в щелочной среде нингидрина (трикетогидринденгидрата, С9НбО4) с веществами, имеющими первичные аминогруппы (—NH2), образуется продукт, который имеет устойчивую интенсивную сине-фиолетовую окраску с максимальным поглощением около 570 нм. Т. к. поглощение при этой длине волны линейно зависит от числа свободных аминогрупп, нингидриновая реакция послужила основой для их количественного определения методами колориметрии или спектрофотометрии. Эта реакция используется также для определения вторичных аминогрупп (>NH) в иминокислотах — пролине и оксипролине; в этом случае образуется продукт ярко-жёлтого цвета. Чувствительность — до 0,01%. Современный автоматический аминокислотный анализ проводят, сочетая ионообменное разделение аминокислот и количественное определение их с помощью нингидриновой реакции. При разделении смесей аминокислот методом бумажной хроматографии позволяет определять каждую аминокислоту в количестве не менее 2—5 мкг.
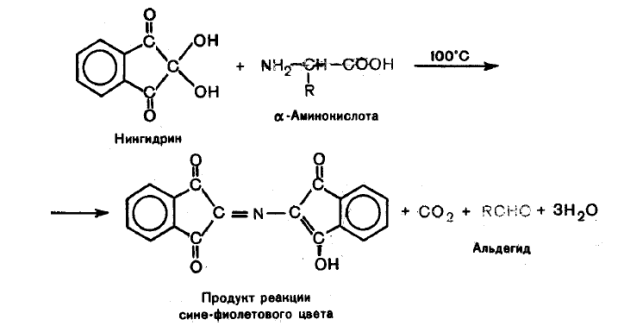
По интенсивности окраски можно судить о количестве аминокислот.
Эта реакция положительна не только со свободными аминокислотами, но и пептидами, белками и др.
Ксантопротеиновая реакция позволяет обнаружить ароматические аминокислоты (фенилаланин, тирозин, гистидин, триптофан), основана на реакции электрофильного замещения в ароматическом ядре (нитрование).
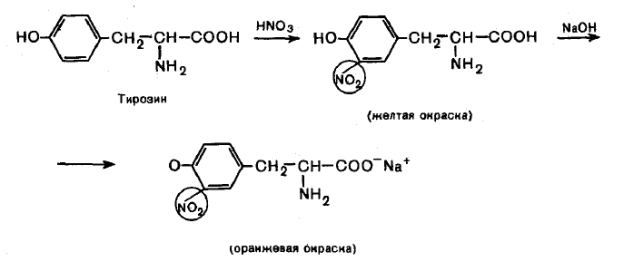
При действии концентрированной азотной кислоты, например, на тирозин образуется продукт, окрашенный в желтый цвет.
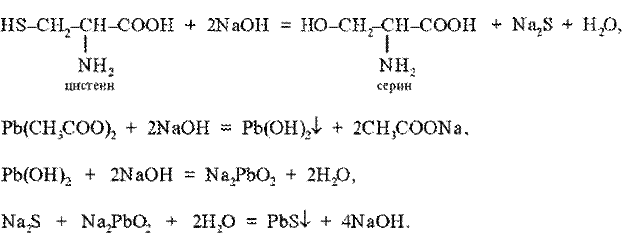
Реакция Фоля. Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Реакция Циммермана. Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
Реакция на триптофан. Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
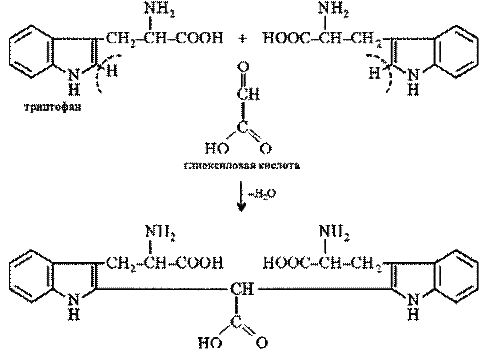
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
Реакция Сакагучи. Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с α-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
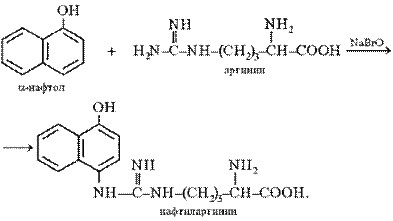
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра α-нафтола:
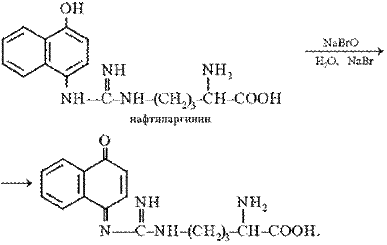
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора α-нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
Биуретовая реакция – используется как цветная реакция на белки. В щелочной среде в присутствии солей меди(II) они дают фиолетовое окрашивание. Окраска обусловлена образованием комплексного соединения меди(II), за счет пептидной группы -СО-NH- , которая характерна для белков. Свое название эта реакция получила от производного мочевины - биурета, который образуется при нагревании мочевины с отщеплением аммиака:
Кроме белков и биурета такое же окрашивание дают и другие соединения, содержащие -эту группу: амиды, имиды карбоновых кислот, а также соединения, содержащие в молекуле группы -CS-NH- или =CH-NH-. Также реакцию дают белки, некоторые аминокислоты, пептиды, биурет и средние пептоны.
Цвет комплекса, получаемый при биуретовой реакции с различными пептидами, несколько отличается и зависит от длины пептидной цепи. Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий.
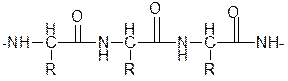
кетонная форма полипептида
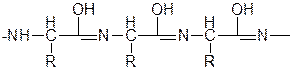
енольная форма полипептида
При взаимодействии полипептида с Cu (OH)2 образуется комплекс, строение которого можно показать так: