Общая жёсткость характеризуется содержанием в воде всех солей кальция и магния.
Л А Б О Р А Т О Р Н Ы Е Р А Б О Т Ы
Лабораторная работа 1
АНАЛИЗ КАЧЕСТВА ВОДЫ
План работы:
1. Требования к качеству питьевой воды
2. Отбор средней пробы
3. Определение общей жёсткости воды
4. Определение общей щёлочности
5. Определение окисленности воды
6. Определение наличия в воде ионов аммония и аммиака
7. Определение нитрит-ионов
8. Определение сульфат-ионов
1. Требования к качеству питьевой воды
Вода является основной частью кваса, пива, безалкогольных и алкогольных напитков и поэтому должна отвечать стандартам на питьевую воду: быть прозрачной, без постороннего запаха и привкуса, микробиологически чистой.
Показателем бактериальной чистоты воды является коли-титр или коли-индекс.
Коли-титр выражает наименьший объём воды, в котором найдена одна кишечная палочка.
Коли-индекс характеризует качество воды по наличию кишечных палочек, содержащихся в 1 дм3 воды. Для водопроводной воды коли-титр должен быть не менее 3 дм3.
По физико-химическим показателям вода должна отвечать следующим требованиям: содержать не более:
– сухого остатка – 100 мг/дм3;
– хлоридов – 350 мг/дм3;
– сульфатов –500 мг/дм3;
– железа – 0,3 мг/дм3;
– марганца – 0,1 мг/дм3;
– меди –1,0 мг/дм3;
– цинка – 5,0 мг/дм3;
– общая жёсткость – 7 мг-экв/дм3;
– рН – 6,5…8,5
2. Отбор средней пробы
Среднюю пробу воды из источника водоснабжения отбирают в тщательно вымытые стеклянные бутылки, после ополаскивания дистиллированной водой закрытые пробками. Воду сливают из водопровода в течение 10 минут, чтобы в пробу не попала застоявшаяся в трубах вода. Бутылки ополаскивают исследуемой водой и заполняют. Для проведения химического анализа требуется не менее 3 дм3 воды.
3. Определение общей жёсткости воды
Количество минеральных солей в воде, используемой на предприятиях пищевой промышленности, оказывает влияние на вкус готовой продукции и ход технологических процессов производства. Особенно большое значение имеет наличие в воде ионов кальция и магния, которые обусловливают её жёсткость (Ж).
Различают общую, временную и постоянную жёсткость воды.
Общая жёсткость характеризуется содержанием в воде всех солей кальция и магния.
Временная жёсткость обусловлена наличием бикарбонатов кальция и магния, выпадающих в осадок при кипячении.
Постоянная жёсткость зависит от содержания в воде солей кальция и магния, которые не выпадают в осадок при кипячении (хлориды, сульфаты и др.).
Жёсткость воды выражают в милиграмм-эквивалентах на 1 дм3 воды: 1 мг-экв. Жёсткости соответствует 20 мг/дм3 ионов кальция или 12,16 мг/дм3 ионов магния.
Метод определения общей жёсткости основан на использовании реакций, которые сопровождаются образованием комплексных соединений катионов с органическим реактивом (комплексоном). В данной методике используют трилон Б.
Посуда и реактивы: пипетки на 100 мл, конические колбы вместимостью 250 см3, цилиндр вместимостью 10 см3, аммиачный буферный раствор, 0,1 н раствор трилона Б, индикатор эриохром чёрный Т.
Техника проведения анализа. В коническую колбу вместимостью 250 мл отмеряют пипеткой 100 см3 анализируемой воды, добавляют 5 мл аммиачного буфера, 7-8 капель индикатора и при интенсивном перемешивании медленно титруют 0,1 н раствором трилона Б до изменения окраски пробы до синего с зеленоватым оттенком.
Жёсткость воды рассчитывают по формуле, мг-экв/дм3:
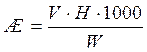 ,
,
где V – расход трилона Б на титрование, см3;
H – нормальность раствора трилона Б;
1000 – пересчёт на 1 дм3 воды;
W – объём взятой на анализ воды, см3.
Пример. На анализ взято 100 мл воды. Расход 0,1 н раствора трилона Б на титрование составили 7,8 см3. Жёсткость воды составит, мг-экв/дм3:
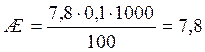
4. ОпределениЕ общей щёлочности
Щёлочность характеризует способность воды связывать кислоты и обусловлена наличием в воде гидратов, карбонатов, и бикарбонатов щёлочноземельных металлов и их солей. Щёлочность выражают количеством милиграмм-эквивалентов указанных ионов в 1 дм3 воды.
Определение щёлочности базируется на реакции нейтрализации, для которой используется раствор соляной кислоты.
Посуда и реактивы: коническая колба вместимостью 250 см3, пипетка на 100 см3, 0,1 н раствор соляной кислоты, смешанный индикатор.
Техника проведения анализа. В коническую колбу колба вместимостью 250 см3 отмеряют пипеткой 100 см3 анализируемой воды, добавляют 3 капли смешанного индикатора и титруют , 0,1 н раствором соляной кислоты до изменения окраски. Щёлочность рассчитывают по формуле:
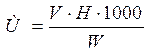 ,
,
где V – расход 0,1 н раствора соляной кислоты на титрование, см3;
H – нормальность раствора соляной кислоты;
1000 – пересчёт на 1 дм3 воды;
W – объём взятой на анализ воды, см3.
5. Определение окисленности воды
Окисленностью называют количества окислителя или эквивалентное ему количество кислорода, которое расходуется на окисление содержащихся в воде примесей. По величине окисленности характеризуют степень загрязнения воды органическими и неорганическими примесями, которые реагируют с сильными окислителями.
В зависимости от вида окислителя, используемого для анализа, различают окисленность перманганатную, бихроматную и др. При анализе питьевой воды чаще используют перманганатную окисленность.
Метод основан на окислении соединений, содержащихся в воде, 0,01 н раствором перманганата калия, который берётся с излишком, в сернокислой среде при кипячении. Для определения количества перманганата калия. пошедшего на окисление, берут такое же количество щавелевой кислоты. Излишек её оттитровывают раствором перманганата калия и по полученным результатам рассчитывают окисленность воды в миллиграммах перманганата калия или в миллиграммах кислорода, который расходуется на окисление примесей в 1 дм3 воды.
Посуда и реактивы: плоскодонные колбы вместимостью 250…300 мл, стеклянные капилляры, часовое стекло, разбавленный в соотношении 1:3 раствор серной кислоты, к которому добавляют 0,01 н раствор перманганата калия до слабо-розового цвета, 0,01 н раствор щавелевой кислоты, 0,01 н раствор перманганата калия.
Техника проведения анализа. В колбу вместимостью 250 мл наливают 100 см3 анализируемой воды, 5 мл серной кислоты и 10 мл 0,01 н раствора перманганата калия. В колбу вносят несколько капилляров, нагревают до кипения и кипятят 10 минут, закрыв горловину колбы часовым стеклом. Затем к горячему раствору приливают 10 мл 0,01 н раствора щавелевой кислоты. Обесцвеченную горячую смесь титруют 0,01н раствором перманганата калия до слабо-розовой окраски. Расход раствора перманганата калия должен быть в пределах 2…7 см3.
Одновременно выполняют контрольный опыт со 100 см3 дистиллированной воды по методике, описанной выше. Перманганатную окисленность рассчитывают по формуле:
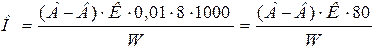 мг кислорода на 1 дм3 воды,
мг кислорода на 1 дм3 воды,
где А, В – расход раствора перманганата калия на титрование
дистиллированной и анализируемой воды, см3;
К – коэффициент поправки к 0,01 н раствору перманганата калия;
8 – эквивалент 1 мг кислорода 1 см3 0,1 н раствора перманганата калия;
W – объём взятой на анализ воды, см3.
6. Определение наличия в воде ионов аммония и аммиака
Метод основан на свойстве аммиака (свободный аммиак и ионы аммония) образовывать со щелочным раствором иодида ртути (1) окрашенные в жёлтый цвет соединения меркураммония. Граница наличия ионов аммония в количестве 0,05 мг в 1 дм3 воды. Выполняется качественный анализ.








