IV . Вопросы и упражнения для защиты лабораторной работы
1. Какова была цель каждого из проделанных опытов?
2. Почему в первом опыте вы наблюдали изменение цвета раствора электролита при добавлении в него гексацианоферрата (III) калия только в одном случае?
3. Почему во втором опыте расчетная и экспериментальная кривые, полученные для меди, практически совпадают, а для железа – нет?
4. Напишите уравнения анодного и катодного процессов, протекающих на меди в растворе сульфата меди и на железе в растворе соли железа (II). В чем принципиальное отличие природы электродных потенциалов, устанавливающихся на меди и на железе?
5. Пользуясь уравнением Нернста объясните, как влияет концентрация собственных ионов металла в растворе электролита на вероятность разрушения металла в этом растворе.
6. Укажите направление переноса зарядов ( электронов и ионов) по внешней и внутренней цепи гальванического элемента.
ЛАБОРАТОРНАЯ РАБОТА № 13
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ.
I. Разделы курса, необходимые для подготовки к лабораторной работе.
Коррозия металлов. Классификация коррозионных процессов. Химическая и электрохимическая коррозия. Причины электрохимической неоднородности поверхности металла. Анодные и катодные процессы при коррозии металлов.
Коррозия с кислородной и водородной деполяризацией. Влияние внешних и внутренних факторов на скорость коррозии. Пассивность металла.
Защита металлов от коррозии. Легирование, защитные покрытия, изменение свойств коррозионной среды, ингибиторы коррозии. Современные конструкционные материалы. Электрохимическая защита.
II. Вопросы и упражнения.
1. Что такое коррозия металлов?
2. По каким признакам можно классифицировать все коррозионные процессы?
3. Как различаются коррозионные процессы по механизму протекания?
4. Какие факторы могут вызвать электрохимическую неоднородность поверхности металла ?
5. Какой анодный процесс происходит при коррозии металлов?
6. Какие процессы могут протекать на катодных участках корродирующей поверхности металла?
7. Что такое поляризация электродов?
8. Какие виды поляризации известны?
9. Что такое процесс деполяризации?
10. Почему в аэрированной воде происходит усиление коррозии железа?
11. Почему ускоряют коррозию: а) сероводород, б) морская вода?
12. Какие методы защиты металлов от коррозии известны?
13. В чем сущность протекторной защиты металлов от коррозии?
14. В чем сущность катодной защиты металлов?
III. Экспериментальная часть
Опыт 1 . Изучение явления поляризации
(опыт проводится под контролем лаборанта)
Соберите установку для изучения электрохимической неоднородности модели металлических конструкций. Для этого стальную пластинку с алюминиевой и медной заклепками и хлорсеребряный электрод сравнения подключите к соответствующим клеммам катодного вольтметра. Погрузите электроды в ячейку с 3% раствором хлорида натрия.
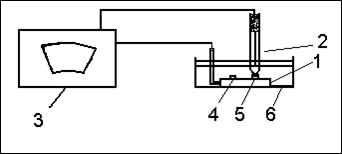 |
Рис. 1. Схема установки для изучения электрохимической неоднородности модели металлической конструкции
I - модель металлической конструкции (стальная пластина с медной и алюминиевой заклепками); 2 - хлорсеребряный электрод сравнения; 3 - катодный вольтметр; 4 - медная заклепка; 5 - алюминиевая заклепка; 6 - ячейка с раствором электролита.
С помощью катодного вольтметра, поочередно прикасаясь кончиком электрода сравнения к стальной пластине и медной и алюминиевой заклепкам, определите величины нестационарных неравновесных электродных потенциалов на поверхности стали, меди и алюминия по отношению к ХСЭ
(jХСЭ/НВЭ = 0,201 В). Занесите полученные результаты в таблицу
| Материал | jэкс/ХСЭ | jэксп/НВЭ | j о | Dj= j о - jэксп/НВЭ | Вывод |
| Сталь* | |||||
| Алюминий | |||||
| Медь |
*Стандартный потенциал стали принять равным потенциалу железа.
Пересчитайте полученные результаты на НВШ и занесите их в таблицу. В эту же таблицу внесите значения стандартных потенциалов для каждого металла. Определите характер поляризации каждого металла (катодная или анодная). Сделайте вывод о роли каждого металла в рассматриваемом гальваническом элементе.








