I . Разделы курса, необходимые для подготовки к лабораторной работе.
Простые вещества. Аллотропия. Сложные вещества. Органические и неорганические вещества. Основные классы неорганических соединений.
Оксиды, их состав и номенклатура. Солеобразующие и индифферентные (безразличные) оксиды. Оксиды основные, кислотные и амфотерные. Химические свойства оксидов. Способы получения.
Кислоты, их состав и номенклатура. Классификация кислот. Основность кислот. Получение кислот и их характерные свойства.
Основания, их состав и номенклатура. Классификация оснований. Способы получения и свойства оснований. Щелочи. Амфотерные гидроксиды.
Соли, их состав и номенклатура. Классификация солей. Соли средние, кислые, основные и двойные. Способы получения солей. Химические свойства солей.
Условия протекания ионообменных реакций до конца.
Генетическая связь между классами неорганических соединений.
Использование веществ, принадлежащих к основным классам неорганических соединений, в нефтяной и газовой промышленности.
II . Вопросы и упражнения
1. Приведите по три примера основных, амфотерных, кислотных и безразличных оксидов. Назовите их. Напишите графические формулы их молекул.
2. Какие гидроксиды соответствуют следующим оксидам: оксид бария, оксид калия, оксид углерода (IV), оксид фосфора (V). Напишите графические формулы их молекул. Назовите их.
3. Какие элементы образуют основные оксиды, а какие - кислотные?
Какими химическими свойствами обладают следующие оксиды: K2O,
Cr2O3, CrO3 ? Подтвердите ответ соответствующими уравнениями реакций.
4. Какими химическими свойствами обладают следующие гидроксиды: Cu(OH)2 ; Zn(OH)2 ; H2SO4? Подтвердите ответ соответствующими уравнениями реакций.
5. Какими способами получают кислоты и основания? Подтвердите ответ уравнениями реакций, в результате которых получаются Ba(OH2); Cu(OH)2; HCl, H2SO4 .
6. Используя следующие вещества CaO, H2O, HCl, Ca(OH)2, SO3, NaOH, Na2CO3 осуществите нижеприведенные превращения:
оксид  основание
основание  основная соль
основная соль  средняя соль;
средняя соль;
оксид  кислота
кислота 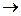 кислая соль
кислая соль 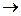 средняя соль;
средняя соль;
гидроксид 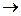 оксид
оксид 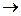 соль
соль
7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cu(OH)2 CuO CuSO4
NaOH → Na2CO3 → NaHCO3 → Na2CO3 → CO2
Zn → ZnO→ Zn(NO3)2→Zn(OH)2→ Na2[Zn(OH)4]
CaO→ Ca(OH)2 → CaOHCl → CaCl2 → CaSO4 → Ca(HSO4)2
III . Экспериментальная часть.








