Кровотечение и кровопотеря у раненых. Инфузионно-трансфузионная терапия при тяжелых ранениях и травмах
7.1. Кровотечение и острая кровопотеря
Кровотечение – одно из наиболее часто встречающихся последствий ранений и травм. При тяжелых сочетанных травмах, повреждении магистральных сосудов оно является жизнеугрожающим последствием ранения или травмы. Острая кровопотеря рассматривается как пусковой механизм тяжелых патофизиологических реакций (нарушение периферической перфузии, гипоксия, ацидоз, дисфункция системы гемостаза, полиорганная недостаточность). Выраженность этих реакций зависит от объема и скорости кровопотери, сроков лечебно-эвакуационных мероприятий и проведения оперативного вмешательства с целью устранения причины кровотечения, а также - исходного состояния раненого, неблагоприятных сопутствующих факторов (гипо- и гипертермия, обезвоживание и др.).
Во время массивного кровотечения возникает дисбаланс между системной доставкой кислорода и потреблением кислорода. Потеря крови приводит к нестабильности гемодинамики, коагулопатии, снижению доставки кислорода, снижению перфузии тканей и клеточной гипоксии. Первоначальная реакция на кровотечение происходит на макроциркуляторном уровне и опосредуется нейроэндокринной системой. Снижение артериального давления приводит к сужению сосудов и высвобождению катехоламинов для сохранения притока крови к сердцу, почкам и мозгу, в то время как другие региональные сосуды сужаются. Боль, кровоизлияние и кортикальное восприятие травматических повреждений приводят к высвобождению гормонов и других медиаторов воспаления, включая ренин, ангиотензин, вазопрессин, антидиуретический гормон, гормон роста, глюкагон, кортизол, адреналин и норадреналин. Эта реакция создает основу для последующей реакции микроциркуляции. Отдельные ишемизированные клетки реагируют на кровоизлияние, поглощая интерстициальную жидкость, тем самым еще больше истощая внутрисосудистую жидкость. Клеточный отек может перекрыть соседние капилляры и привести к феномену невозможности реперфузии, даже при восстановлении адекватной макроперфузии. Если перфузия тканей уменьшается, ишемизированные клетки вырабатывают лактат и свободные радикалы, которые накапливаются в интерстиции и сосудистом русле. Эти соединения наносят прямой ущерб клетке и образуют основную часть токсинов при восстановлении перфузии тканей. Ишемизированные клетки также продуцируют и высвобождают факторы воспаления — простациклин, тромбоксан, простагландины, лейкотриены, эндотелин, комплемент, интерлейкины, фактор некроза опухоли и другие. Эта воспалительная реакция, однажды начавшись, становится патологическим процессом, независимым от его происхождения. Такие изменения закладывают основы для последующего развития ПОН, системного воспалительного ответа, сепсиса, которые приводят к дисфункции различных жизненно важных органов и являются причиной высокой смертности.
Острая коагулопатия. Первично комбинация травматического повреждения и нарушения перфузии тканей вызывает коагулопатию, связанную со снижением уровня протеина С. Активированный протеин С реализует свой антикоагулянтный эффект за счет необратимой инактивации факторов Vа и VIIIа. Дальнейшая антикоагуляционная активность реализуется за счет деактивации ингибитора активатора плазминогена, что приводит к усилению фибринолиза. В дополнение протеин С активирует рецептор клеточной поверхности, активируемый протеиназами-1 (PAR-1), тем самым реализуя ряд защитных клеточных эффектов за счет усиления противовоспалительной активности, антиапоптотической активности, защитной функции в отношении эндотелия, что повышает вероятность выживания организма при шоке. Суммарно коагулопатия характеризуется системной коагулопатией/гипокоагуляцией в сочетании с гиперфибринолизом.
Повреждение гликокаликса. Эндотелий играет ключевую роль в патофизиологии острой массивной кровопотери, шока и коагулопатии. Повышенная сосудистая проницаемость при шоке характеризуется деградацией апикального слоя гликокаликса эндотелиоцитов. Симпатоадреналовая активация в ходе шока является одним из факторов, вызывающих патологию эндотелия и деградацию гликокаликса.
Гипотермия — еще один важный фактор формирования коагулопатии. Снижение температуры ведет к нарушению функции ферментов, в том числе ферментов свертывания. Нарушается клеточный компонент гемостаза из-за снижения интенсивности агрегации и адгезии. Следует отметить и тот факт, что in vivo измерения гемостазиологических тестов могут отличаться от реальных условий организма, когда при острой массивной кровопотере свертывание происходит в условиях гипотермии. В условиях гипотермии нарушается морфология тромбоцитов, на каждый 1 °С гипотермии функция свертывания снижается на 10% от нормального потенциала.
Ацидоз. Анаэробный метаболизм в условиях шока и избыточное вынужденное переливание больших объемов несбалансированных кристаллоидных растворов ведут к метаболическому ацидозу. Причины нарушений свертывания на фоне острых расстройств рН обусловлены угнетением ферментной активности на фоне снижения рН ниже физиологических величин, угнетением функции тромбоцитов с формированием их сферической конфигурации без внешних псевдоподий, ингибирование генерации тромбина, усилением деградации фибриногена. Вероятным вариантом стратегии инфузионной терапии с позиции измененного рН при шоке и кровопотере является прежде всего предпочтение компонентов крови, отказ от несбалансированных кристаллоидов и/или переход к сбалансированным инфузионным кристаллоидным средам.
Гипокальциемия является фактором, усугубляющим формирование коагулопатии на фоне метаболического ацидоза. Содержание свободного ионизированного кальция, необходимого для сборки факторов свертывания на поверхности тромбоцитов и эндотелия, коррелирует с уровнем рН. Кальций необходим не только для полимеризации фибрина и функции тромбоцитов, но и для фибринолиза и активации системы протеина С. Содержащие цитрат компоненты в донорской крови и коллоидные растворы усугубляют дефицит кальция в крови, равно как и накапливающийся при шоке лактат.
Учитывая важность коагулопатии у пациентов с ранениями и тяжелыми травмами, оценка системы гемостаза имеет важное значение на ранних этапах лечения. Она достигается путем сбора и интеграции информации из основных компонентов периоперационного мониторинга коагуляции: (1) клиническая картина, (2) стандартные лабораторные тесты на коагуляцию и (3) мониторинг тромбоэластометрии.
Клиническая оценка направлена на то, чтобы определить, является ли причина кровотечения “хирургической” или “нехирургической”. Стандартные лабораторные тесты на свертываемость крови обычно включают протромбиновое время, международное нормализованное отношение, активированное частичное тромбопластиновое время, фибриноген и количество тромбоцитов. Стандартные тесты на свертываемость крови сами по себе играют ограниченную роль на начальных этапах диагностики пациентов с нарушением гемостаза вследствие травмы. Основными ограничениями стандартных тестов на свертывание крови являются: задержка результатов в динамической ситуации, отсутствие подтверждения и неспособность обнаружить как гиперфибринолиз, так и гиперкоагуляцию. Недавний метаанализ показал, что стандартные тесты на свертывание плазмы не были подтверждены доказательствами для лечения коагулопатических кровотечений. Именно здесь мониторинг тромбоэластометрии в качестве четвертого столпа оценки периоперационной коагуляции приносит дополнительную пользу. Устройства для контроля тромбоэластометрии, такие как RapidTEG и ROTEM, оценивают весь процесс коагуляции от начального образования тромбина до максимального образования сгустка и до лизиса сгустка. В отличие от стандартных лабораторных тестов на коагуляцию, TEG и ROTEM были лучше проверены для диагностики коагулопатии у пациентов с травмой. Эти тесты могут значительно улучшить оценку свертываемости крови и ведение данного пациента; и они могут уменьшить ненужное введение прокоагулянтов, таких как тромбоциты, свежезамороженная плазма (СЗП) и концентраты факторов свертывания. Быстрое получение результатов может в дальнейшем позволить анестезиологу различать хирургическую причину кровотечения и связанную с травмой коагулопатию.
Острая кровопотеря приводит к гиповолемии – несоответствию объема оставшейся в активной циркуляции крови и емкости сосудистого русла. При профузном кровотечении, острой массивной кровопотере резко уменьшается венозный приток к сердцу, следствием чего может произойти остановка «пустого» сердца. Стратегия спасения таких раненых основывается на максимально быстрой временной остановке кровотечения (уменьшение кровопотери), ранней инфузионной терапии ограниченного объема (уменьшение гиповолемии на период транспортировки раненого в лечебное учреждение), управляемой гипотонии (для уменьшения внутренней кровопотери), ранней гемостатической терапии, сокращении сроков окончательной остановки кровотечения и устранения причин шока.
Классификация кровотечений. По виду поврежденного сосуда различают артериальное (пульсирующая струя алого цвета), венозное (более медленное заполнение раны кровью темно-вишневого цвета), артериовенозное (смешанное), капиллярное (паренхиматозное) кровотечение.
По срокам возникновения кровотечений выделяют первичные (непосредственно при повреждении сосудов) и вторичные. Последние могут быть ранними (выталкивание тромба, дефекты сосудистого шва, разрыв стенки сосуда при ее неполном повреждении, расслоение стенки сосуда) и поздними (вследствие развития местных инфекционных осложнений).
В зависимости от локализации различают наружные и внутренние (внутриполостные и внутритканевые) кровотечения.
Классификация острой кровопотери. Согласно клиническим рекомендациям Общероссийская общественная организация «Федерация анестезиологов и реаниматологов» «Протокол реанимации и интенсивной терапии при острой массивной кровопотере» выделяют 4 класса острой кровопотери (по Воробьеву А. И. с соавт., 2002) (табл. 7.1.).
Таблица 7.1.
Классификация острой кровопотери
| Параметр | Класс | |||
| I | II | III | IV | |
| Кровопотеря, мл | < 750 | 750 – 1500 | 1500 – 2000 | > 2000 |
| ОЦК % | < 15 | 15 – 30 | 30 – 40 | > 40 |
| Пульс, в мин. | < 100 | > 100 | > 120 | > 140 |
| АД, мм рт.ст. | Нормальное | Нормальное | Понижено | Резко понижено |
| Пульсовое давление | Нормальное или повышено | Понижено | Понижено | Резко понижено |
| ЧДД, в мин. | 14 - 20 | 20 - 30 | 30 - 40 | > 40 |
| Почасовой диурез, мл | > 30 | 20 - 30 | 5 - 15 | Анурия |
| СимптоматикаЦНС | Отсутствует | Возбуждение | Заторможенность | Оглушение, кома |
Ориентировочное определение величины кровопотери. Наибольшее распространение для определения величины острой кровопотери у раненых имеют простые и быстро реализуемые методики:
- по характеру и локализации повреждений (см. табл. 6.2. главы 6), клиническим признакам кровопотери, гемодинамическим показателям (ЧСС, сист.АД),
- по концентрационным показателям крови (гематокрит, гемоглобин, эритроциты) – см. табл. 6.3. главы 6.
В ранние сроки после ранения определение величины кровопотери по концентрационным показателям крови малоинформативно и становится достоверным только после устранения гиповолемии. В то же время показатели газового состава крови (pH, дефицит оснований) и уровень лактата достоверно указывают на степень гипоперфузии при острой кровопотере и шоке уже в ранние сроки.
7.2. Организация инфузионно-трансфузионной терапии у раненых
Инфузионно-трансфузионная терапия на этапах медицинской эвакуации основывается на следующих принципах:
- соответствие ее объема и содержания виду и объему помощи, установленному для данного этапа медицинской эвакуации;
- раннее начало проведения;
- дифференцированное (с учетом ведущего синдромокомплекса) применение соответствующих гемотрансфузионных средств и плазмозаменителей;
- постоянный контроль над основными показателями гомеостаза у раненого;
- сочетание инфузионно-трансфузионной терапии с другими лечебными методами и средствами патогенетической терапии.
Инфузионная терапия является краеугольным камнем интенсивной терапии кровопотери. Внутрисосудистый объем теряется из-за кровотечения, поглощения ишемизированными клетками и экстравазации в интерстициальное пространство. Внутривенное введение жидкостей предсказуемо увеличит сердечный выброс и артериальное кровяное давление у пациента с гиповолемией. В настоящее время терапия острой кровопотери должна начинаться с 1 л кристаллоида (предпочтительно сбалансированного) и максимально раннего использования крови и препаратов крови для пациентов в состоянии шока. Такой подход исключает агрессивную инфузию коллоидов и кристаллоидов во время активного кровотечения, поскольку разжижение эритроцитарной массы уменьшает доставку кислорода и способствует гипотермии и коагулопатии. Повышение артериального давления может привести к усилению кровотечения из-за разрушения свертков и отмены компенсаторной вазоконстрикции. Результатом агрессивного введения жидкости часто является временное повышение артериального кровяного давления, за которым следует усиление кровотечения, еще один эпизод гипотензии и необходимость введения еще большего объема. Этот порочный круг расценивается сегодня как ошибочная тактика интенсивной терапии. Руководство ATLS характеризует таких пациентов как “временно реагирующих” с активным продолжающимся кровотечением.
Интенсивная терапия острой массивной кровопотери имеет особенности в зависимости от фазы контроля кровотечения (табл. 7.2.).
▪ Фаза 1, неконтролируемое кровотечение: продолжающееся активное кровотечение с акцентом на контроль повреждений с помощью прагматичной интенсивной терапии;
▪ Фаза 2, контролируемое кровотечение: основные источники кровотечения под контролем с акцентом на целенаправленное и индивидуальное лечение коагулопатии и реанимации;
▪ Фаза 3, восстановление физиологии: кровотечение полностью контролируется с акцентом на перфузию органов и оптимизацию физиологического состояния.
Таблица 7.2.
Этапы интенсивной терапии острой массивной кровопотери
| Фаза 1 | Фаза 2 | Фаза 3 | |
| Клинический статус | Опасное для жизни неконтролируемое кровотечение | Продолжающееся кровотечение — не представляющее непосредственной угрозы для жизни - частичный хирургический контроль | Контролируемое кровотечение |
| Клинические приоритеты | ОСТАНОВИТЬ КРОВОТЕЧЕНИЕ Позовите на помощь Контроль дыхательных путей, FiO2 1,0 Интенсивная терапия устранения повреждений СистАД <100 мм рт. ст. СрАД 50-60 мм рт. ст. Рассмотрите варианты, если ЧМТ, стеноз сонной артерии, ИБС | ИНДИВИДУАЛЬНАЯ ИНТЕНСИВНАЯ ТЕРАПИЯ Катетеризация сосудов (артериальные / ЦВК) Предотвращение переохлаждения Подогретые жидкости Согревающие одеяла (верхние/нижние) Увеличьте температуру в помещении | ВОССТАНОВЛЕНИЕ ФИЗИОЛОГИИ Быстрая внутрисосудистая инфузия Поэтапное углубление анестезии Болюсы с фентанилом Увеличение объемной концентрации ингаляционных анестетиков Дополнительные линии (мочевой катетер, назогастральный зонд) Общайтесь со всеми членами команды и отделением интенсивной терапии |
| Препараты крови | Активировать протокол массивного переливания компонентов крови Рассмотреть неотложную помощь (кровь универсального донора) Раннее использование Эмпирическое соотношение 1: 1: 1 (эритроциты: свежезамороженная плазма: тромбоциты) | Тромбоэластометрия для целевой коррекции свертывания крови Переливание эритроцитов под контролем гемоглобина | Только по мере необходимости при тестировании При необходимости прекратить переливание компонентов крови |
| Кристаллоиды / коллоиды | Осторожное использование | Использовать при гиповолемии с нормальной коагуляцией / гемоглобином Для определения потребностей в инфузии ориетироваться на уровень лактата /дефицита оснований | Попытка нормализовать уровень лактата /дефицита оснований |
| Особые моменты | Добавляйте CaCl 2 (1 г на каждые три пакета эритроцитов) Внутривенный доступ с большим диаметром (> 16 G) или ЦВК Система быстрого вливания Избегайте сосудосуживающих средств | При необходимости рассмотрите возможность спасения клеток Стремитесь повторять тромбоэластрографию каждые 30 минут | Рассмотрите возможность введения вазоактивных средств, если это возможно / необходимо |
Средства, используемые для проведения инфузионно-трансфузионной терапии, представлены в табл. 7.3.
Таблица 7.3.
Гемотрансфузионные средства, плазмозамещающие инфузионные растворы
| Наименование | Основные лечебные свойства |
| ГЕМОТРАНСФУЗИОННЫЕ СРЕДСТВА | |
| Кровь консервированная (донорская, аутогенная) | Газотранспортная, гемостатическая функция |
| Эритроцитная взвесь (масса), эритроциты лейкофильтрованные |
Газотранспортная функция |
| Отмытые эритроциты | |
| Эритроциты размороженные отмытые | |
| Свежезамороженная плазма карантинизированная | Гемостатическая функция (коррекция плазменно-коагуляционного гемостаза) |
| Свежезамороженная плазма вирусинактивированная | |
| Свежезамороженная плазма иммунная | Иммунокорригирующая функция |
| Криопреципитат | Гемостатическая функция |
| Альбумин (5, 10 и 20%-ный раствор) | Волемическая, реологическая функция, транспорт лекарственных средств, препаратов крови, метаболитов, токсинов и др. |
| Тромбовзвесь, тромбоконцентрат. | Гемостатическая функция |
| ПЛАЗМОЗАМЕНИТЕЛИ ГЕМОДИНАМИЧЕСКОГО ДЕЙСТВИЯ | |
| Растворы желатины (желатиноль, 8% раствор желатины, гелеспан) | Волемическое действие, гемодилюция |
| Растворы гидроксиэтилкрахмала (I поколение – стабизол; II поколение – HAES, гемохес, рефортан ГЭК; III поколение – волювен, венофундин) | Волемическое, реологическое и гемодинамическое действие, восстановление микроциркуляции |
| ИНФУЗИОННЫЕ РАСТВОРЫ | |
| 0.9% раствор натрия хлорида | Возмещение потерь жидкости из сосудистого русла и внеклеточного пространства |
| 5% раствор глюкозы | |
| Стерофундин (Натрия хлорид+Калия хлорид+Кальция хлорида дигидрат+Магния хлорида гексагидрат+Натрия ацетата тригидрат+Яблочная кислота | Возмещение потерь жидкости из сосудистого русла и коррекция ацидоза |
| Лактасол (Калия хлорид+Кальция хлорид+Магния хлорид+Натрия лактат+Натрия Хлорид) | |
| Мафусол (ионы: калия хлорид + магния хлорид + натрия хлорид + натрия фумарат) | Гемодинамическое, диуретическое и дезинтоксикационное действие |
Аутогемотрансфузия (использование собственной крови раненых) применяется чаще всего в виде реинфузии – обратного переливания крови, собранной во время операции из серозных полостей (выделившейся по дренажам), а также в ближайшие часы после завершения операции из стерильных дренажных устройств. Сбор и реинфузия крови показаны при повреждениях органов груди и живота, сопровождающихся массивным кровотечением в полости плевры и брюшины. Противопоказания к реинфузии – поздние (более 6 часов) сроки после травмы; повреждение ряда полых органов (толстой кишки, желчевыводящих путей, поджелудочной железы, мочевого пузыря, крупных бронхов); гемолиз крови (уровень свободного гемоглобина в крови – 2,0 и более г/л); явления перитонита; инфицирование крови.
Излившуюся в полости кровь для реинфузии собирают, соблюдая требования асептики, в стерильные сосуды с помощью специальных аппаратов (селл-сэйверов) или систем, а при их отсутствии – путем вычерпывания или с помощью вакуумного отсасывания (при минимальных степенях вакуумизации). Для стабилизации крови используются стандартные гемоконсерванты или гепарин (500 ЕД на 500 мл крови). Перед реинфузией кровь, излившаяся в рану или по дренажам, должна быть отмыта с использованием 0,9% раствора хлорида натрия. Собранную кровь фильтруют через специальный фильтр или через марлю (6-8 слоев) и возвращают раненому не позднее чем через 3 часа после сбора.
7.3. Инфузионно-трансфузионная терапия на этапах медицинской эвакуации
Введение инфузионных растворов раненым с острой массивной кровопотерей и нестабильной гемодинамикой необходимо начинать как можно раньше сразу после остановки наружного кровотечения. Нестабильность гемодинамики в полевых условиях может быть условно определена как отсутствие пульса на лучевой артерии.
При оказании доврачебной и первой врачебной помощи инфузия растворов используется с целью устранения опасной для жизни пациента гиповолемии и стабилизации гемодинамики на период транспортировки раненых на последующий этап медицинской эвакуации.
При острой массивной кровопотере и тяжелом шоке инфузию начинают со струйного введения растворов в периферические вены с объемной скоростью, позволяющей добиться подъема цифр не более систолического АД до 90-100 мм рт.ст. При этом предпочтительно вводить кристаллоидные (лучше, сбалансированные по электролитам). После стабилизации сист. АД на уровне более 90 мм рт.ст. переходят на капельное введение плазмозаменителей (обычно в объеме 1000 мл). Используют с этой целью растворы, расфасованные в полимерные контейнеры, что позволяет продолжать инфузионную терапию в процессе транспортировки раненого. Проведение инфузионной терапии не должно быть причиной задержки эвакуации раненого. При осуществлении воздушной санитарной эвакуации врачом, оснащенным переносным холодильником, возможно переливание раненым с острой массивной кровопотерей эритроцитной взвеси (массы) 0(I) группы до 500 мл (после пробы на индивидуальную совместимость).
При оказании квалифицированной и специализированной медицинской помощи инфузионно-трансфузионная терапия применяется в комплексе с другими лечебными мерами при подготовке к операции, во время ее проведения, в послеоперационном периоде, а также для предупреждения и коррекции нарушений гомеостаза у раненых.
Гемотрансфузионная терапия для наиболее тяжелых, нестабильных раненых с большой кровопотерей возможна в виде реинфузии крови, переливания свежестабилизированной крови от заранее обследованных доноров и переливания компонентов крови, привозимых в портативных холодильниках группами медицинского усиления. Начиная с ВПГ (МП) (3-й уровень), врачами трансфузиологами организуется оказание трансфузиологической помощи с использованием банка (запаса) крови и необходимого оборудования.
Потребность в соответствующих средствах для каждого раненого определяется индивидуально с учетом тяжести травмы, кровопотери, сроков оказания помощи и степени кровопотери на основании клинических и лабораторных показателей.
Программа инфузионно-трансфузионной терапии исходит из ориентировочного объема крововопотери и общего состояния раненого. Неконтролируемое использование инфузионных растворов приводит к тяжелой коагулопатии, лежащей в основе «смертельной триады» (коагулопатия, гипотермия, ацидоз). Чем тяжелее состояние, тем более сбалансированной должна быть инфузионно-трансфузионная терапия: уменьшение объема введенных инфузионных сред и увеличение объема компонентов крови (рис 7.1.)
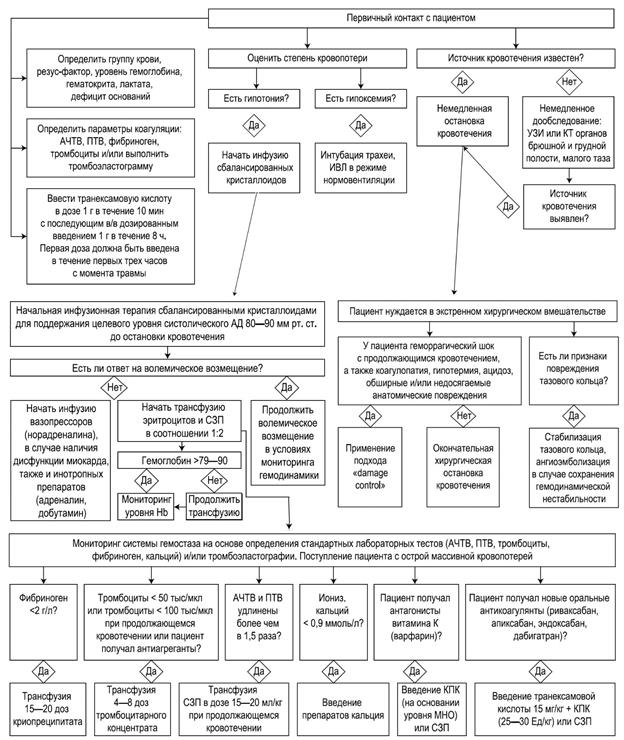
Рисунок 7.1. Тактика интенсивной терапии острой массивной кровопотери
Следует учитывать, что использование плазмозамещающих жидкостей сопряжено с многочисленными факторами риска: гемодилюцией и ее последствиями (пороговые значения: Hb – 60-80 г/л, Ht – 0,18-0,25). Это отрицательные воздействия на систему гемостаза (гемодилюционная коагулопатия, нестойкость свертков, подавление функции тромбоцитов), активация системы комплемента (местные аллергические реакции, анафилактический шок, накопление коллоидов в клетках ретикуло-эндотелиальной системы, отрицательное действие макромолекул коллоидных растворов на функцию почек), иммуногематологические аберрации (снижение экспрессии антигенов на мембране эритроцитов, неспецифическая гемагглютинация), опасность внутриклеточного обезвоживания при избыточном введении коллоидных растворов на начальном этапе реанимационных мероприятий, опасность гиперволемии[9]. Поэтому выбор кровезамещающего раствора и объем его введения должны определяться соответствующими клиническими проявлениями (например, признаки гиповолемии, нарушения периферического кровотока, интоксикация и др.), а достаточность дозы – достижением требуемого эффекта или появлением признаков наличия факторов риска. Инфузионная терапия у раненого проводится под контролем соответствующих показателей (клинических и лабораторных) гемостаза.
Из искусственных коллоидных кровезамещающих растворов препаратами выбора являются среднемолекулярные низкозамещенные гидроксиэтилкрахмалы, растворы желатины, из кристаллоидных растворов – сбалансированные полиионные растворы.
В наибольшей степени применение сбалансированных инфузионных растворов с целью более быстрой стабилизации гемодинамики, уменьшения степени выраженности нарушений кислотно-основного состояния целесообразно при острой кровопотере крайне тяжелой степени в случае реализации тактики многоэтапного хирургического лечения («контроль повреждения») с сокращением объема первого оперативного вмешательства. При снижении сист. АД ниже 70 мм рт. ст. применение метода «малообъемной реанимации» (сочетание гиперосмотических, гиперонкотических, объемозамещающих растворов – натрия хлорид (7,5%), гидроксиэтилкрахмал 200/0,5 или декстран молекулярной массой 35000-45000 D) у раненых с острой кровопотерей крайне тяжелой степени позволяет существенно сократить длительность критического снижения АД, уменьшить частоту использования препаратов, обеспечивающих инотропную поддержку.
Коррекция анемического синдрома при острой массивной кровопотере осуществляется как в предоперационном периоде (при возможности, начиная с догоститального этапа - кровью 0(I) группы), так и в ходе основного этапа хирургической операции по остановке кровотечения уже одногруппной кровью. Критерием достаточности переливания эритроцитосодержащих компонентов и консервированной крови является устранение клинических признаков гипоксии в условиях самостоятельного дыхания пациента.
При отсутствии одногруппной эритроцитной взвеси (массы) по жизненным показаниям допускается переливание эритроцитной взвеси (массы) 0(I) группы реципиентам всех групп, а групп А(II) и В(III) - лицам с АВ(IV) группой, при этом объем переливаемой эритроцитной взвеси (массы) не должен превышать 500 мл (2 дозы).
Особого контроля у каждого раненого с острой кровопотерей требует состояние свертывающей системы крови. При этом следует учитывать факт возможного исчерпания компенсаторных возможностей, прежде всего, плазменно-коагуляционного, а в особо тяжелых случаях - и сосудисто-тромбоцитарного звена гемостаза. Поэтому обязательной составной частью инфузионно-трансфузионной терапии у каждого раненого с кровопотерей ³ 30% ОЦК уже на начальном этапе является переливание свежезамороженной плазмы (СЗП), потребность в которой может колебаться от 500 до 1500 мл в зависимости от величины кровопотери, сроков оказания хирургической помощи, наличия или отсутствия острой коагулопатии и ряда других факторов. Достаточность переливания СЗП оценивают по клиническим и лабораторным показателям. В отдельных случаях целесообразно использовать тромбовзвесь или тромбоконцентрат, а также гемостатические препараты протромбинового комплекса – факторы свертывания крови в комбинации II, VII, IX, X (протромплекс), рекомбинантный активированный VII фактор свертывания (для раненых, нуждающихся в массивных гемотрансфузиях). Целесообразно раннее (не позднее 3 часов после ранения) внутривенное введение 1,0 г транексамовой кислоты всем пациентам, нуждающимся в гемотрансфузии. Идеальную прицельную коррекцию нарушений в системе гемостаза можно проводить под контролем тромбоэластометрии.
Переливание эритроцитосодержащих компонентов в первые 7-10 суток после ранения как правило не обеспечивает выведение лабораторных показателей содержания гемоглобина на уровень физиологических значений. В этих условиях лечебная тактика, направленная на непременную нормализацию лабораторных критериев гомеостаза, является ошибочной. Достаточным является устранение у раненого признаков гипоксии, обусловленных дефицитом газотранспортной функции крови.
В тыловых ВМО при наличии у раненого факторов риска возникновения гемолитических осложнений (выявление антиэритроцитарных антител) обязательным является привлечение подготовленного врача-иммуногематолога для выполнения индивидуального подбора эритроцитосодержащих компонентов, а также использование реинфузии крови, излившейся в серозные полости (плевра, брюшина), если к этому нет противопоказаний. Пациентам, у которых выявлены факторы риска возникновения посттрансфузионных реакций и осложнений негемолитического типа (HLA-аллосенсибилизация и др.) обязательным является исключение или максимально возможное снижение примесных клеток или белков плазмы крови. Это достигается лейкофильтрацией гемокомпонентов или их деплазмированием с ресуспендированием в растворах гемоконсервантов. Основная нагрузка в решении этой задачи лежит на производственном звене службы крови (отряды заготовки крови - ОЗК, станции переливания крови - СПК, отделения заготовки и переливания крови - ОЗПК). Если такой подход не обеспечил требуемое решение, обязательным является использование прикроватных лейкоцитарных фильтров.
Использование гемотрансфузионных (гемотерапевтических) средств в целях коррекции вторичного иммунодефицита возможно при тяжелых септических осложнениях, обусловленных стафилококком, синегнойной палочкой (иммунная плазма соответствующей специфичности), сепсисе (специфические иммуноглобулины для внутривенного введения).
Стабилизация водно-электролитного обмена у раненого невозможна без контроля содержания альбумина в крови (в норме ³ 36 г/л) и коррекции гипоальбуминемии (< 28-30 г/л). При наличии показаний, струйно-капельным способом переливают изоонкотический (5%) раствор альбумина. Использование гиперонкотических (10-20%) растворов альбумина чаще реализуется капельным способом (до 2 мл/мин) и сопряжено с опасностью развития гиперволемии.
7.4. Ошибки инфузионно-трансфузионной терапии у раненых
Наиболее частыми ошибками при проведении инфузионно-трансфузионной терапии на этапах медицинской эвакуации являются:
- доставка раненых с массивной кровопотерей и тяжелым шоком в лечебное учреждение без проведения инфузионной терапии,
- избыточное введение инфузионных растворов,
- переоценка информативности гематологических показателей (количество эритроцитов, показатели гемоглобина, гематокрита) у раненых в первые 1-2 часа после ранения, при неустраненной гиповолемии,
- проведение инфузионно-трансфузионной терапии без динамического контроля показателей кровообращения (АД, ЦВД), состава периферической крови (эритроциты, гематокрит, содержание белка, осмолярность плазмы, время свертывания крови и др.); в результате может иметь место недостаточное или избыточное введение инфузионных растворов,
- отказ от реинфузии крови при отсутствии абсолютных противопоказаний к ее применению.
- расширение показаний к катетеризации центральных вен, выполнение этой операции лицами, не имеющими соответствующих навыков и подготовки; при необходимости быстрого возмещения кровопотери в отсутствие возможности постановки центрального катетера необходимо катетеризировать 2-3 периферические вены, использовать венесекцию большой подкожной вены (кпереди от медиальной лодыжки в области голеностопного сустава)
- ошибки ввиду несоответствия истинной группы крови и татуировок с группой крови у раненых.
7.5. Техника переливания компонентов и препаратов крови
Перед переливанием компонентов крови врач обязан:
- удостовериться в доброкачественности переливаемой среды;
- независимо от ранее проведенных исследований проверить групповую принадлежность крови донора и реципиента, исключить их групповую несовместимость;
- провести пробы на индивидуальную групповую и резусную совместимость, а также биологическую пробу.
Оценка качества гемотрансфузионной среды складывается из проверки паспорта, герметичности сосуда и макроскопического осмотра. Паспорт (этикетка) должен содержать сведения о наименовании среды, названии ВМО-изготовителя, дате заготовки, дате окончания срока хранения, групповой и резусной принадлежности, идентификационного номера кроводачи, объеме компонента (крови), наименовании и объеме консервирующего раствора, температуре хранения. При внешнем осмотре среды не должно быть признаков гемолиза, посторонних включений, сгустков, помутнения и других признаков возможного инфицирования.
Групповую принадлежность крови донора и реципиента определяют либо гелевой методикой, либо двумя сериями стандартных сывороток или реагентами (цоликлоны анти-А и анти-В).
Для проведения пробы на индивидуальную групповую совместимость (по системе АВ0) на чистую сухую поверхность планшета или пластинки при комнатной температуре наносят и смешивают в соотношении 10:1 сыворотку реципиента и кровь донора. Периодически покачивая планшет, наблюдают за ходом реакции. При отсутствии агглютинации в течение 5 минут кровь совместима.
Проба на индивидуальную совместимость по резус-фактору проводится в пробирке с применением 33% раствора полиглюкина. На дно пробирки помещают одну маленькую каплю крови донора, затем туда же добавляют 2 капли сыворотки крови пациента и одну каплю 33 % раствора полиглюкина. Содержимое пробирки перемешивают путем однократного встряхивания. Затем пробирку в течение 5 минут вращают вдоль продольной оси и добавляют 2-3 мл физиологического раствора. После перемешивания двух-трехкратным перевертыванием пробирки просматривают содержимое в проходящем свете. Агглютинация указывает на несовместимость крови донора и реципиента по резус-фактору, а следовательно, и на недопустимость переливания данного образца компонента (крови).
Биологическая проба предшествует переливанию каждой отдельной дозы трансфузионной среды для исключения ее индивидуальной несовместимости с кровью реципиента или непереносимости. Первые 50 мл среды вводят струйно тремя порциями по 10-15 мл с трехминутными перерывами между введениями. Если не появляются субъективные (боли, неприятные ощущения) и объективные (резкое изменение пульса, артериального давления и др.) признаки непереносимости, переливание продолжают до конца.
Переливание компонентов крови должно проводиться из сосуда, в котором они заготовлены. Перед переливанием сосуд с трансфузионной средой необходимой подогреть, используя специальные устройства или выдерживая при температуре от +18 до +25оС в течение 30-60 мин. В ходе трансфузии врач и средний медицинский персонал контролируют самочувствие реципиента и его реакцию на переливание. После гемотрансфузии определяют непосредственный лечебный эффект, а также отсутствие реакции (осложнения). Через сутки после переливания эритроцитосодержащих сред необходимо провести анализ мочи и клинический анализ крови.
Каждый случай переливания компонентов крови записывают в историю болезни, в которой отражают: показания к гемотрансфузии, информированное согласие реципиента (при наличии сознания), название перелитой среды и ее паспортные данные, пробы, проведенные перед переливанием, метод переливания, время начала и окончания и реакцию раненого на переливание.
Контейнеры с остатками компонентов крови и растворов, добавленных к эритроцитной взвеси (массе), а также пробирки с кровью, использованной для проведения проб на совместимость, сохраняют в холодильнике в течение 2 суток для проверки в случае возникновения посттрансфузионного осложнения.
7.6. Посттрансфузионные реакции и осложнения
Проведение инфузионно-трансфузионной терапии может сопровождаться пострансфузионными реакциями и осложнениями у реципиента. Различают пирогенные, аллергические и анафилактические реакции и осложнения. Причинами их развития является поступление бактериальных пирогенов, продуктов распада лейкоцитов, сенсибилизация реципиента к антигенам, имеющимся в составе вводимой среды. Легкие реакции выражаются в общем недомогании, повышении температуры тела, появлении кратковременного озноба у реципиента, отеков, уртикарной сыпи, зуда. Более тяжелая реакция: тошнота, рвота, мышечные боли, сильный и продолжительный озноб с повышением температуры тела до 38-39оС. При анафилактической реакции появляются удушье, одышка, цианоз, тахикардия со снижением артериального давления, а в крайне тяжелых случаях – развивается анафилактический шок.
При возникновении посттрансфузионных реакций проводится лечение, включающее постельный режим, введение сердечных препаратов (0,5-1 мл 0,6% раствора коргликона в 20 мл 40% раствора глюкозы внутривенно), 2 мл 50% раствора анальгина внутримышечно, десенсибилизирующих и антигистаминных препаратов (2 мл 2,5% раствора пипольфена, 1-2 мл 1% раствора димедрола внутримышечно, 10 мл 10% раствора хлорида или глюконата кальция внутривенно); в тяжелых случаях – 60-120 мг преднизолона. При анафилактическом шоке проводят комплексное лечение, направленное на восстановление гемодинамики (коргликон, преднизолон повторно, лактасол или 0,9% раствор хлорида натрия - 0,5 л), дыхания (2,4% раствор эуфиллина 10 мл в 20 мл 40% раствора глюкозы), искусственную вентиляцию легких, обязательно включают методы дезинтоксикации и стимуляции диуреза.
Осложнения возникают также вследствие неправильного определения групповой и резусной принадлежности крови донора и реципиента, неправильного проведения пробы на индивидуальную совместимость, биологической пробы, нарушения техники трансфузии; переливания недоброкачественной крови (инфицированной, перегретой, замороженной, гемолизированной).
Несовместимость крови донора и реципиента по антигенам эритроцитов возникает при переливании реципиенту крови или эритроцитосодержащих компонентов, несовместимых по системам АВ0, резус или редким групповым антигенам. Время наступления: в процессе трансфузии и в первые 4 часа. Причиной осложнений в большинстве случаев является невыполнение или нарушение правил, предусмотренных инструкциями по технике переливания крови, методике определения групп крови АВ0 и проведения проб на групповую совместимость.
Клинические проявления гемотрансфузионного шока выражаются в ознобе, появлении чувства стеснения в груди, болей в пояснице, тахикардии, снижении артериального давления, падении сердечной деятельности. При АВ0 несовместимости отмечают развитие внутрисосудистого гемолиза, анурии, гемоглобинурии, гематурии. При резус-несовместимости или наличии антиэритроцитарных иммунных антител другой специфичности преобладают признаки внесосудистого гемолиза. Позднее присоединяются явления острой печеночно-почечной недостаточности (желтушность кожи и слизистых, билирубинемия, олигоанурия, гипостенурия, азотемия, ацидоз, гиперкалиемия).
Общими принципами терапии являются: немедленное прекращение гемотрансфузии для исключения увеличения количества несовместимых эритроцитов в крови реципиента; быстрое определение степени тяжести реакции и начало лечения; поддержание почечного кровотока внутривенным введением диуретиков до завершения реанимации и стабилизации гемодинамики больного.
Лечение гемотрансфузионного шока :
1. Прекратить переливание несовместимой крови.
2. Инъекция сердечно-сосудистых, спазмолитических, антигистаминных средств (1 мл 0.06% коргликона в 20 мл 40% глюкозы, 2-3 мл 1% димедрола, 2% супрастина или 2,5% дипразина) и глюкокортикостероидов (90-150 мг преднизолона или до 1250 мг гидрокортизона внутривенно). При необходимости введение глюкокортикостероидов повторяют.
3. Переливание 400-800 мл гидроксиэтилкрахмала (130/0,4), 200-400 мл 5% гидрокарбоната натрия (до щелочной реакции мочи при отсутствии контроля КОС) или 400 мл 10% лактасола, 200-300 мл 5% глюкозы, 1000 мл 0,9% хлорида натрия.
4. Внутривенное капельное введение гепарина в дозе 50-70 ЕД на 1 кг массы тела в 100-150 мл 0,9% р-ра хлорида натрия (при отсутствии потенциального источника кровотечения)
5. Введение фуросемида (внутривенно 80-100 мг, через час 40-60 мг, а затем внутривенно по 40 мг через 2-4 ч). Фуросемид рекомендуется сочетать 2,4% эуфиллином, который вводят внутривенно по 10 мл 2 раза через час
6. Если стимуляция диуреза дает эффект, то диурез следует поддерживать в течение 2-3 суток путем внутримышечного введения фуросемида по 20-40 мг каждые 4-8 ч под строгим контролем водного баланса.
Для лечения анемии в периоде гемотрансфузионного шока показана трансфузия 500 мл свежезаготовленной совместимой донорской крови или 250-300 мл эритроцитарной массы.
Меры, направленные на выведение из организма продуктов распада эритроцитов, продолжают 1-2 суток до получения лечебного эффекта. Если осложнение выявлено в более поздние сроки или проведенное лечение не предупредило развития острого повреждения почек, показано проведение экстракорпоральной детоксикации.
При эмболии воздухом или кровяными свертками применяют комплексное лечение, направленное на восстановление гемодинамики, сердечной деятельности и дыхания, кроме того, при тромбоэмболии показано введение антикоагулянтов.
ВАЖНО:
1. До 60% раненых на поле боя умирают от кровотечения. Это основная потенциально предотвращаемая причина смерти. Умение своевременно и правильно остановить кровотечение – обязанность каждого военнослужащего.
2. Инфузия плазмозамещающих растворов при наличии показаний должна начинаться как можно раньше, однако неконтролируемое применение большого количества инфузионных сред ведет к нарушению внутренних механизмов антигенной защиты организма.
3. В полевых условиях отсутствие пульса на лучевой артерии раненого является ориентиром, указывающим на нестабильность гемодинамики, что, соответственно, требует проведения инфузионной терапии.
4. Определение концентрационных показателей крови помогает в оценке объема кровопотери, но редко бывает достоверной в острый период ранения и/или травмы. Газовый состав крови и уровень лактата являются более информативными показателями.
5. При тяжелой кровопотере основой ее восполнения должны служить компоненты крови. В отсутствие достаточного количества компонентов крови целесообразно переливание по жизненным показаниям крови 0(I) резус-отрицательной группы.
6. Реинфузия крови – ценный метод восполнения кровопотери. Противопоказания к реинфузии (том числе и с применением селл-сейвера) – поздние (более 6 часов) сроки после травмы; повреждение ряда полых органов (толстой кишки, желчевыводящих путей, поджелудочной железы, мочевого пузыря, крупных бронхов); гемолиз крови (уровень свободного гемоглобина в крови – 2,0 и более г/л); явления перитонита; инфицирование крови.
Глава 8








