Занятие №16 Тема: « Строение, свойства и биологическая роль α-аминокислот. Структурная организация и физико-химические свойства белков».
1. Вопросы для обсуждения:
1. Строение α-аминокислот.
2. Классификация аминокислот.
· в соответствии со строением углеводородного радикала (алифатические, ароматические, гетероциклические).
· в соответствии с количеством –COOH и NH2 групп. Примеры.
· в соответствии с взаимодействием радикала с водой (гидрофильные, гидрофобные). Примеры.
· по заряду (отрицательно заряженные, положительно заряженные, нейтральные - полярные и неполярные аминокислоты).
· по возможности синтеза в организме (заменимые, незаменимые).
3. Виды изомерии аминокислот. Оптическая изомерия α-аминокислот.
4. Кислотно-основные свойства. Формы аминокислот в растворе. Цвиттерион (биполярный ион). Изоэлектрическая точка аминокислот.
5. Химические свойства аминокислот:
· Реакции по карбоксильной группе (нейтрализации, этерификации, амидирования, декарбоксилирования).
· Реакции по аминогруппе: дезаминирования (окислительного, неокислительного), трансаминирования (переаминирования).
· Реакция поликонденсации. Строение пептидной связи.
6. Определение, классификация белков (глобулярные и фибриллярные; простые и сложные).
7. Уровни организации белковых молекул: первичная, вторичная, третичная, четвертичная.
8. Типы химических связей, стабилизирующих первичную, вторичную, третичную, четвертичную структуры белка.
9. Белки – полиэлектролиты. Изоэлектрическая точка белков.
10. Физико-химические свойства белков. Реакции осаждения белков. Денатурация.
11. Качественные реакции на аминокислоты и белки.
12. Медико-биологическая роль аминокислот и белков.
2. Выполнить тестовые задания (письменно):
| 1. | В состав всех изученных в настоящее время белков организма человека входят: | |
| А | аминокислоты L - ряда | |
| Б | нуклеиновые кислоты | |
| В | аминокислоты D - ряда | |
| Г | карбоновые кислоты | |
| 2. | Как называется качественная реакция на ароматические аминокислоты? | |
| А | биуретовая реакция | |
| Б | ксантопротеиновая реакция | |
| В | нингидриновая реакция | |
| Г | реакция Фоля | |
| 3. | Из предложенных аминокислот выбрать незаменимую: | |
| А | аланин | |
| Б | глутаминовая кислота | |
| В | триптофан | |
| Г | серин | |
| 4. | В состав аминокислот не входят: | |
| А | сера | |
| Б | азот | |
| В | углерод | |
| Г | фосфор | |
| 5. | Биогенный амин гистамин образуется в организме человека из гистидина в результате реакции: | |
| А | трансаминирования | |
| Б | дезаминирования | |
| В | декарбоксилирования | |
| Г | гидролиза | |
| 6. | При декарбоксилировании серина образуется биогенный амин: | |
| А | холин | |
| Б | этиламин | |
| В | фениламин | |
| Г | этаноламин (коламин) | |
| 7. | Пептиды синтезируются в результате реакции: | |
| А | полимеризации | |
| Б | трансаминирования | |
| В | гидролиза | |
| Г | поликонденсации | |
| 8. | Связь между двумя a-аминокислотными остатками называется: | |
| А | водородная | |
| Б | пептидная | |
| В | гликозидная | |
| Г | сложноэфирная | |
| 10. | В организме человека в синтезе нейромедиатора серотонина участвует биогенный амин – триптамин. При декарбоксилировании какой аминокислоты он образуется? | |
| А | фенилаланин | |
| Б | триптофан | |
| В | серотонин | |
| Г | тирозин | |
| 11. | Процесс превращения аминокислоты в непредельную кислоту, протекающий в присутствии ферментов, называется: | |
| А | трансаминированием | |
| Б | декарбоксилированием | |
| В | окислительным дезаминированием | |
| Г | неокислительным дезаминированием | |
| 12. | a - Спиральная форма и β – структура полипептидных цепей, образующиеся в результате действия внутримолекулярных или межмолекулярных водородных связей, является: | |
| А | первичной структурой белка | |
| Б | вторичной структурой белка | |
| В | третичной структурой белка | |
| Г | четвертичной структурой белка | |
| 13. | Реакцией взаимообмена в организме аминогруппы и карбонильной группы аминокислот под действием фермента транс-аминазы является реакция: | |
| А | трансаминирования | |
| Б | восстановительного аминирования | |
| В | декарбоксилирования | |
| Г | окислительного дезаминирования | |
| 14. | Кадаверин или 1,5-диаминопентан (трупный яд) образуется в результате реакции декарбоксилирования: | |
| А | изолейцина | |
| Б | лейцина | |
| В | лизина | |
| Г | метионина | |
| 15. | Значение рН, при котором в растворе белка содержится максимальное количество биполярных ионов, а заряд равен нулю: | |
| А | электрокинетический потенциал | |
| Б | порог коагуляции | |
| В | точка эквивалентности | |
| Г | изоэлектрическая точка | |
| 16. | Специфической реакцией на пептидную (амидную) связь является: | |
| А | нингидриновая реакция | |
| Б | реакция Фоля | |
| В | биуретовая реакция | |
| Г | ксантопротеиновая реакция | |
| 17. | Специфической реакцией на аминогруппу, находящуюся в α-положении аминокислоты, является: | |
| А | нингидриновая реакция | |
| Б | реакция Фоля | |
| В | биуретовая реакция | |
| Г | ксантопротеиновая реакция | |
| 18. | Для очистки белков от низкомолекулярных примесей неэлектролитов пользуются методом: | |
| А | диализа | |
| Б | электродиализа | |
| В | фильтрацией | |
| Г | адсорбцией | |
| 19. | Разрушение четвертичной, третичной и вторичной структур белков и результате какого-либо воздействия (жесткое излучение, химические реагенты, нагревание, высокое давление) называется: | |
| А | гибридизация | |
| Б | седиментация | |
| В | денатурация | |
| Г | коагуляция | |
| 20. | Природные аминокислоты хорошо растворимы в воде, т.к. содержат | |
| А | бензольное кольцо | |
| Б | аминогруппу и карбоксильную группу | |
| В | гидроксильную группу | |
| Г | гетероциклические кольца |
2. Задания для самостоятельного решения (выполнить письменно):
1) Дописать уравнения реакций, назвать продукты:
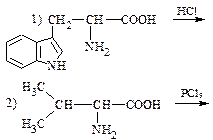
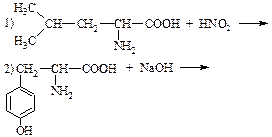
2) Записать уравнения реакций, назвать продукты:
а) глутаминовая кислота + NH3 →
б) лейцин + С2Н5OH →
в) декарбоксилирование лизина →
г) окислительное дезаминирование аспарагиновой кислоты →
д) трансаминирование (аспарагиновая кислота + α-кетоглутаровая) →
3) Назвать трипептиды, определить заряд в водном растворе при рН=7:
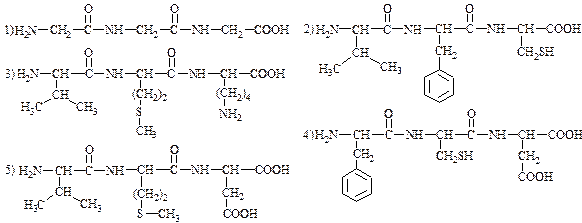
4) Записать тетрапептид состава Вал – Лиз – Асп – Фен, назвать, указать заряд в нейтральной среде.
5) В лабораторию на анализ поступил пептид неизвестного строения. В лаборатории имеются следующие реактивы: нингидрин; п-диметиламино-бензальдегид; азотная кислота; 2,4-динитрофторбензол. Какой из реактивов следует выбрать для выделения и идентификации N-концевой α-аминокислоты?
6) На анализ поступила моча пациента. В лаборатории имеются следующие реактивы: раствор CuSO4, раствор NaOH, KMnO4, ZnCI2, Na2SO4, K2CrO7. Требуется экстренно определить, содержится ли в моче пациента белок. Какой из приведенных реактивов может быть использован для идентификации белка в моче? Какие связи в белке позволяет обнаружить предложенный вами реактив?
Лабораторная работа: «Свойства аминокислот».
1. Отношение к воде, отношение к индикатору.
После просмотра опыта по ссылке - https://www.youtube.com/watch?v=VfUFFxIDzOg, записать наблюдаемые эффекты:
2. Качественные реакции на аминокислоты.
А) Биуретовая реакция (проба на пептидную связь).
После просмотра опыта по ссылке - https://www.youtube.com/watch?v=_UD9x2qiJfE, записать наблюдаемые эффекты:
Б) Ксантопротеиновая реакция.
После просмотра опыта по ссылке - https://www.youtube.com/watch?v=lP0X-REeqmg, записать наблюдаемые эффекты:
3. Денатурация белков (нагревание, взаимодействие с кислотой, солями тяжелых металлов).
После просмотра опыта по ссылке - https://www.youtube.com/watch?v=LGXgR_yWYEw, записать наблюдаемые эффекты:
ВЫВОД:








