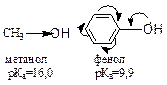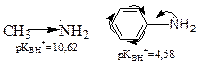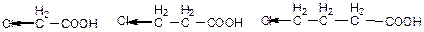З аняти е № 11 Тема: « Кислотность и основность органических соединений. Строение и химические свойства гидрокси- и оксосоединений».
1. Вопросы для обсуждения:
| 1. | Кислотные и основные свойства органических соединений: протонная теория Бренстеда, теория кислот и оснований Льюиса. |
| 2. | Строение и свойства одно- и многоатомных спиртов. Механизм реакций нуклеофильного замещения и элиминирования в спиртах. Медико-биологическое значение этих реакций. |
| 3. | Строение и номенклатура простых эфиров, тиоспиртов (меркаптанов). |
| 4. | Строение, свойства и медико-биологическое значение одноатомных и двухатомных фенолов. |
| 5. | Окисление спиртов, фенолов, тиолов. Биологическое значение этих реакций. |
| 6. | Строение и номенклатура аминов. Аминоспирты (этаноламин, холин). Медико-биологическое значение. |
2. Выполнить тестовые задания (письменно):
| 1. | Этиленгликоль (составная часть криопротекторов для тканей и органов) образуется при пропускании через водный раствор перманганата калия: | |
| А | метана | |
| Б | этана | |
| В | этена | |
| Г | ацетилена | |
| 2. | Вещества, образующие с Сu(OH)2 ярко-синий раствор: | |
| А | этанол | |
| Б | глицерин | |
| В | толуол | |
| Г | этиленгликоль | |
| 3. | Замещение водородов в феноле идет по положенням атомов углерода бензольного кольца: | |
| А | 2,4,6- | |
| Б | 3,5- | |
| В | 2,3,4- | |
| Г | 2,5- | |
| 4. | К какому типу реакций относится реакция взаимодействия этанола с пропанолом-1. Назвать продукт. | |
| А | пентан, реакция замещения | |
| Б | пропилэтиловый эфир, реакция присоедиения | |
| В | пропилацетат, реакция замещения | |
| Г | пентанон-2, реакция замещения | |
| 5. | Вещество, обесцвечивающее бромную воду с образованием белого осадка: | |
| А | фенол | |
| Б | этанол | |
| В | ацетон | |
| Г | глицерин | |
| 6. | Указать название продукта реакции
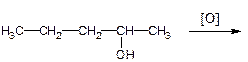
| |
| А | пентаналь | |
| Б | пентанон-2 | |
| В | пентановая кислота | |
| Г | пентанон-3 | |
| 7. | Пропаналь и ацетон можно различить с помощью: | |
| А | лакмуса | |
| Б | аммиачного раствора Ag2O | |
| В | ацетата натрия | |
| Г | соляной кислоты | |
| 8. | Назвать продукт реакции:
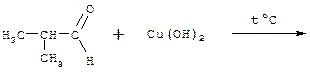
| |
| А | бутанол-2 | |
| Б | 2-метилпропанол-1 | |
| В | ацетон | |
| Г | 2-метилпропановая кислота | |
| 9. | Наиболее реакционноспособным соединением в реакциях нуклеофильного присоединения является: | |
| А | этаналь | |
| Б | пропанон | |
| В | 3-метилбутаналь | |
| Г | хлораль | |
| 10. | Веществом, которое реагирует с этанолом, но не реагирует с фенолом, является… | |
| А | Na | |
| Б | NaOH | |
| В | HCl | |
| Г | бромная вода | |
| 11. | В альдегидах наиболее подвижен атом водорода в … | |
| А | альдегидной группе | |
| Б | α-положении цепи | |
| В | β-положении цепи | |
| Г | γ-положении цепи | |
| 12. | Реакции в углеводородном радикале по α-СН-кислотному центру возможны для следующих оксосоединений: | |
| А | 2-этилпентаналь | |
| Б | бензальдегид | |
| В | ацетон | |
| Г | 2,2-диметилбутаналь | |
| 13. | З-метилбутанол-2 может быть получен путем восстановления соединения: | |
| А | 3-метилбутаналь | |
| Б | пентанон-2 | |
| В | 2-метилбутанон-З | |
| Г | З-метилбутанон-2 | |
| 14. | Формалин (консервант для анатомических препаратов) представляет собой водный раствор… | |
| А | муравьиной кислоты | |
| Б | ацетальдегида | |
| В | метанола | |
| Г | муравьиного альдегида | |
| 15. | Среди следующих веществ наиболее выраженные кислотные свойства проявляет: | |
| А | фенол | |
| Б | вода | |
| В | 2,4,6-тринитрофенол | |
| Г | этанол | |
| 16. | 5% водный раствор фенола используется в качестве дезинфицирующего средства и называется… | |
| А | фенольной водой | |
| Б | карболовой кислотой | |
| В | фенольной кислотой | |
| Г | формалином | |
| 17. | Механизм разрыва связи О – Н в спиртах: | |
| А | гомолитический | |
| Б | гетеролитический | |
| В | атомный | |
| Г | молекулярный | |
| 18. | При восстановлении каких соединений образуются первичные и вторичные спирты: | |
| А | альдегиды | |
| Б | карбоновые кислоты | |
| В | спирты | |
| Г | кетоны | |
| 19. | Формула диэтилового эфира (средство для наркоза): | |
| А | С2Н5 – СО – О – С2Н5 | |
| Б | С2Н5 – О – С2Н5 | |
| В | С2Н5 – О – СН3 | |
| Г | С2Н5ОН | |
| 20. | Расположить в ряд по увеличению кислотности: фенол, этанол, метанол, глицерин, этиленгликоль, этаналь, уксусная кислота, хлоруксусная кислота. | |
| А | Фенол, этанол, метанол, глицерин, этиленгликоль, этаналь, уксусная кислота, хлоруксусная кислота. | |
| Б | Этанол, фенол, этиленгликоль, метанол, глицерин, уксусная кислота, этаналь, хлоруксусная кислота. | |
| В | Метанол, этанол, этиленгликоль, глицерин, фенол, этаналь, уксусная кислота, хлоруксусная кислота. | |
| Г | Этанол, этаналь, метанол, глицерин, этиленгликоль, фенол, уксусная кислота, хлоруксусная кислота. |
2. Вспомогательный материал:
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ПО ТЕОРИИ БРЕНСТЕДА
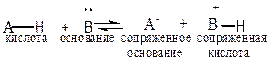
| Кислота – любое вещество , способное отдавать протон ( донор ). Мерой силы кислоты А – Н является константа кислотности Ка. Чем больше значение Ка , тем сильнее кислота . рКа = - lg Ka Чем меньше значение рКа , тем сильнее кислота . | Основание – вещество , способное принимать протон ( акцептор ). Мерой силы основания Чем меньше значение Кв , тем сильнее основание . рКв = - lg Kв Чем больше значение рКвн + , тем сильнее основание .
| ||
Типы органических кислот
В зависимости от природы кислотного центра (элемента, с которым связан атом водорода, обусловливающий кислотные свойства), органические кислоты подразделяются на четыре основных типа:
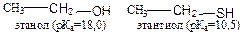
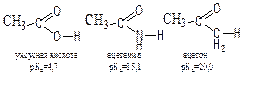
| Типы органических оснований В зависимости от природы основного центра (атом с неподеленной парой электронов или электроны π-связи), органические основания подразделяются на n-основания и π-основания: По природе центра основности р-основания классифицируют на: 1. Аммониевые (центр основности 2. Оксониевые (центр основности относятся спирты, простые эфиры, альдегиды, кетоны, сложные эфиры, амиды кислот и др. 3. Сульфониевые (центр основности В π-основаниях центром основности являются электроны π-связи. К ним относятся алкены, алкадиены, арены.
В зависимости от природы основного центра органические основания можно расположить по возрастанию основности в ряд: p -основания < сульфониевые < оксониевые < аммониевые | ||
| Кислотность зависит от строения радикала, связанного с кислотным центром. Алкильные радикалы (благодаря +I-эффекту) увеличивают электронную плотность в кислотном центре и тем самым дестабилизируют анион, что приводит к уменьшению кислотности. Ароматические радикалы, наоборот, способствуют увеличению кислотных свойств.
| |||
Заместители, обладающие (+ I; + M) понижают кислотность; заместители, обладающие (- I; - M) повышают кислотность.
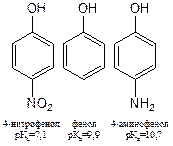
| Заместители, обладающие (+ I; + M) повышают основность; заместители, обладающие (- I; - M) понижают основность.
| ||
| В алифатическом ряду наиболее сильное влияние на кислотность оказывают заместители, ближе расположенные к кислотному центру, например:
монохлоруксусная b-хлорпропионовая g-хлормасляная кислота (рКа=2,86) кислота (рКа=4,1) кислота (рКа=4,5) | |||
3. Задания для самостоятельного решения (выполнить письменно):
1. Назвать соединения: 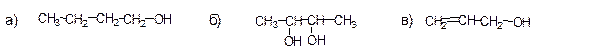
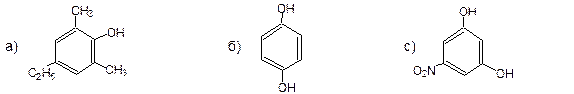
2. Записать СТРУКТУРНЫЕ формулы следующих соединений:
| а) 2-(гидроксиэтил)-триметиламмония гидроксид (участвует в транспорте жиров и метаболизме белков и углеводов) – | |
| б) 2-аминоэтанол (входит в состав сложных липидов) – | |
| в) бензилбензоат (средство, применяемое против чесотки) – | |
| г) метилсалицилат (ненаркотический анальгетик) – | |
| д) цис-бутен-2-диовая кислота (используется в качестве пищевой добавки, ЗАПРЕЩЕНА!!!) – |
3. Привести схемы реакций, которыми можно различить соединения в следующих парах:
а) этанол и этиленгликоль, б) пропаналь и пропанон, в) муравьиная и уксусная кислоты.
4. В крови здорового человека содержание кетонових тел составляет 0,85-1,7 ммоль\л. При патологи (тяжелые формы сахарного диабета, голодание), происходит интенсивное образование и накопление кетонових тел (до 20 ммоль\л).
Какие вещества относят к кетоновым телам?
ОПРЕДЕЛЕНИЕ: ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Записать структурные формулы кетонових тел (с названими).
5. Расположить в ряд по уменьшению кислотности группы следующих соединений (записать структурные формулы).
| а) метиловый, изопропиловый, трет-бутиловый спирты; а) ответ: | б) 2-бромэтанол, этанол, 2,2,2-трибромэтанол; б) ответ: |
| в) н-пропиловый спирт, этиленгликоль, глицерин; в) ответ: | г) фенол, п-нитрофенол, п-аминофенол; г) ответ: |
| д) этиловый спирт, этантиол, фенол; д) ответ: | е) аммиак, этиламин, ацетамид CH3-CO-NH2; е) ответ: |









 является константа основности Кв.
является константа основности Кв.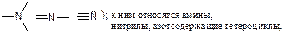
 относятся тиоспирты, тиоэфиры.
относятся тиоспирты, тиоэфиры.