2. Комплекс кальмодулин - 4 Са2+ активирует киназу легких цепей миозина.
3. Активная киназа фосфорилирует легкую цепь р.
4. Фосфорилированная легкая цепь «р» перестает ингибировать взаимодействие миозина с F-актином.
5. Миозин взаимодействует с F-актином, активируется АТФаза, начинается сократительный цикл.'
Расслабление гладких мышц происходит, когда:
1. Падает содержание ионов Са2+ в саркоплазме ниже КГ7 ммоль/л.
2. Са2+ отсоединяется от кальмодулина, который, в свою очередь, отделяется от киназы легкой цепи миозина, вызывая ее инактивацию.
3. Нового фосфорилирования легкой цепи «р» не происходит. Протеинфосфатаза отщепляет от легкой цепи «р» фосфаты.
4. Дефосфорилированная легкая цепь «р» миозина ингибирует связывание миозиновых головок с F-актином и подавляет активность АТФазы.
5. Миозиновые головки в присутствии АТФ отделяются от Fактина. Мышца расслабляется.
118. Метаболизм мышц. Энергетика мышечного сокращения: роль креатинфосфата, карнозина и ансерина. Изменение метаболизма при мышечной работе. Ммэмсрккиаимпмр
Метаболизм мышц
Различают белые и красные мышечные волокна. В красных мышцах содержится много миоглобина, который служит внутриклеточным резервом 0 2. Красные мышцы содержат многочисленные митохондрии с плотно упакованными складчатыми мембранами. Они расположены в непосредственной близости к сократительным миофибриллам, которые используют АТФ, образующуюся в митохондриях при окислительном фосфорилировании. Для этого класса скелетных мышц характерно медленное сокращение и способность длительное время оставаться в состоянии сокращения. В мышцах, функции которых требуют коротких, быстрых движений, мало миоглобина и митохондрий, поэтому их называют белыми мышцами. Они содержат большие запасы гликогена в цитоплазме и их функция зависит преимущественно от анаэробного гликолиза как источника АТФ.
У человека нет специализированных мышц, но есть специализированные волокна: в мышцах-разгибателях больше "белых" волокон, в мышцах спины больше "красных” волокон.
У людей при голодании главным после жира источником запасенной энергии служит белок скелетных мышц. Это объясняет очень большую потерю мышечной массы при длительном голодании. В ходе внутриклеточного распада актина и миозина образуется 3- метилгистидин, который выводится с мочой. По скорости выведения его с мочой можно судить о скорости деградации мышечных белков Мышцы являются главным местом катаболизма аминокислот с раз, ветвленной цепью. Образующиеся при этом аминогруппы в ходе реакций трансаминирования переносятся на а-кетоглутарат и пируват с образованием глутамата и аланина. Источником почти всего пирувата идущего на синтез аланина, является глюкоза, поступающая в мышцу из печени. Аланин из мышц поступает в печень, где его углеродный скелет используется в глюконеогенезе, a NH2 группа удаляется в виде мочевины (глюкозо-аланиновый цикл).
В мышцах действуют 3 АТФ-завнсимых механизма:
1. Натриевый насос клеточной мембраны;
2. Кальциевый насос внутри самой клетки;
3. Миозин-актиновое взаимодействие (сокращение-расслабление).
Мышца потребляет огромное количество энергии. То количество АТФ, которое имеется в мышце, может поддерживать сократительную активность всего лишь на протяжении доли секунды. Однако в мышцах позвоночных богатые энергией фосфатные связи запасаются в виде креатинфосфата. Это макроэргическое соединение в термодинамической шкале стоит выше АТФ, поэтому при участии креатинкиназы (КК) может происходить перенос фосфата от креатинфосфата к АДФ с образованием АТФ (субстратное фосфорилирование).
Креатинфосфат + АДФ АТФ + КРЕАТИН
В работающей мышце запас креатинфосфата быстро истощается, а, следовательно, снижается и содержание АТФ. При этом возрастает концентрация АДФ и Рн, а также уровень АМФ.
Накопление АМФ, АДФ (аллостерические активаторы) приводит к стимуляции гликолиза, ЦТК и окислительного фосфорилирования, что приводит к восстановлению резервов АТФ и креатинфосфата Это самый быстрый способ ресинтеза АТФ. Максимально эффективен. Не требует присутствия кислорода, не дает побочных нежелательных продуктов, включается мгновенно. Его недостаток - малый резерв субстрата (хватает только на 20 с работы). Обратная реакция может протекать в митохондриях с использованием АТФ, образовавшейся в процессе окислительного фосфорилирования.
Мембрана митохондрий хорошо проницаема как для креатина, так и для креатинфосфата, а креатинфосфокиназа есть и в саркоплазме, и в межмембранном пространстве митохондрий.
Миокиназная реакция. Протекает только в мышечной ткани.
АДФ----- ► АТФ + АМФ.
Реакция катализируется миокиназой (аденилаткиназой). Главное значение этой реакции заключается в образовании АМФ - мощного ^аллостерического активатора ключевых ферментов гликолиза, глико- ; генолиза.
Анаэробный гликолиз и гликогецрлиз. Не требуют присутствия кислорода (анаэробные процессы). Обладают большим^ резервом суб1стратов. Используется гликоген мышц (2 % от веса мышцы) и глюкоза 'крови, полученная из гликогена печени. Недостатки следующие: небольшая эффективность - 3 АТФ на один глюкозный остаток гликогеt на; накопление недоокисленных продуктов (лактат); анаэробный глиГ колиз начинается не сразу — только через 10-15 с после начала мышечной работы.
Окислительное фосфорилирование. Преимущества: это наиболее энергетически выгодный процесс - синтезируется 38 молекул АТФ при окислении одной молекулы глюкозы. Имеет самый большой резерв субстратов: может использоваться глюкоза, гликоген, глицерин, кетоновые тела. Продукты распада (С02 и Н20) практически безвредны. Недостаток: требует повышенных количеств кислорода.
Важную роль в обеспечении мышечной клетки кислородом играет миоглобин, у которого сродство к кислороду больше, чем у гемоглобина: при парциальном давлении кислорода, равном 30 мм.рт.сг., миоглобин насыщается кислородом на 100 %, а гемоглобин - всего на 30 %. Поэтому миоглобин эффективно отнимает у гемоглобин доставляемый им кислород.
Основные источники энергии в мышечной ткани в покое: Рокисление жирных кислот, кетоновые тела; при работе (в зависимости от снабжения 0 2) - анаэробный гликолиз, гликогенолиз, ЦТК.
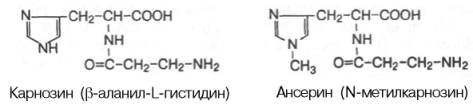
В скелетных мышцах, кроме адениловых нуклеотидов (АТФ, АДФ, АМФ), креатинфосфата, креатина содержатся и другие небелковые азотистые вещества — карнозин и ансерин. Это имидазол содержащие дипептиды. Синтезируются из конечного продукта распада пиримидиновых нуклеотидов - р-аланина. Эти соединения активируют Nа,К,АТФазу, а также увеличивают амплитуду мышечного сокращения, предварительно сниженную утомлением.
Изменение метаболизма при мышечной работе
Уменьшение концентрации АТФ смещает равновесие креатинфосфокиназной реакции вправо: используется креатинфосфат. Далее включается гликолиз, так системе окислительного фосфорилирования необходима 1 мин для запуска. Это Пусковая фаза мышечной работы.
Дальше изменения метаболизма зависят от интенсивности мышечной работы: если мышечная работа длительная и небольшой интенсивности, то в дальнейшем клетка получает энергию путем окислительного фосфорилирования - это работа в "аэробной зоне"; если мышечная работа субмаксимальной интенсивности, то - дополнительно к окислительному фосфорилированию включается анаэробный гликолиз — это наиболее тяжелая мышечная работа — возникает "кислородная задолженность", это — работа "в смешанной зоне”; если мышечная работа максимальной интенсивности, но непродолжительная, то механизм окислительного фосфорилирования не успевает включаться. Работа идет исключительно за счет анаэробного гликолиза. После окончания максимальной нагрузки лактат поступает из крови в печень, где идут реакции глюконеогенеза, или лактат превращается в пируват, который дальше окисляется в митохондриях. Для окисления пирувата нужен кислород, поэтому после мышечной работы максимальной и субмаксимальной интенсивности потребление кислорода мышечными клетками повышено - возвращается кислородная задолженность (долг).
Существует наследственная предрасположенность к мышечной работе - у одних людей больше "быстрых" мышечных волокон - им рекомендуется заниматься теми видами спорта, где мышечная работа максимальной интенсивности, но кратковременная (тяжелая атлетика, бег на короткие дистанции и тому подобное). Люди, в мышцах которых больше "красных" ("медленных") мышечных волокон, наибольших успехов добиваются в тех видах спорта, где необходима длитель5 3 2 ная мышечная работа средней интенсивности, например, марафонский бег (дистанция 40 км). Для определения пригодности человека к определенному типу мышечных нагрузок используется пункционная биопсия мышц.
В результате скоростных тренировок (bodybuilding) утолщаются миофибриллы, кровоснабжение возрастает, но непропорционально увеличению массы мышечных волокон, количество актина и миозина возрастает, увеличивается активность ферментов гликолиза и креатинфосфокиназы.
Более полезны для организма тренировки "на выносливость". При этом мышечная масса не увеличивается, но увеличивается количество миоглобина и митохондрий.
119. Биохимия нервной ткани. Молекулярные механизмы адренергической передачи, особенности, нарушения. Бнтммапон
Медиаторами адренэргической передачи являются катехоламины - норадреналин, адреналин, дофамин. Механизм их синтеза в нервной системе такой же, как и в мозговом веществе надпочечников.
Норадреналин встречается в основном в симпатической нервной системе, в стволе мозга и в гипоталамусе.
Дофамин обнаруживается в полосатом теле и в базальных ганглиях. В адренэргических синапсах нет систем, разрушающих медиаторы в синаптической щели. Вместо этого на пресинаптической мембране есть рецепторы для медиатора, взаимодействие с ними прекращает освобождение в щель новых порций медиатора. Кроме этого, в синаптической щели есть специальная транспортная система для выкачивания медиатора из синапса. Реабсорбированный норадреналин либо вновь повторно используется, либо инактивируется ферментами МАО, метилированием. С нарушением дофаминэргической передачи связана болезнь Паркинсона. У больных отмечается ригидность мышц, маскообразное лицо, задержка начала движений. Концентрация дофамина в хвостатом ядре и скорлупе снижена. При шизофрении высказано предположение об избыточной дофаминэргической передаче. Известно, что все лекарства, которые являются эффективными при шизофрении, вызывают блокаду дофаминовых рецепторов. Отсюда побочное действие этих препаратов: возникновение симптомов, характерных для болезни Паркинсона.
120. Биохимия нервной ткани. Молекулярные механизмы холинэргической передачи, особенности, нарушения. Бнтммхпон
Нарушение холинэргической передачи
При заболевании миастения в крови находят антитела против собственных рецепторов ацетилхолина, что приводит к нарушению нейромышечной передачи, что проявляется мышечной слабостью (широкий зрачок, расслабление мышц). Лекарственные препараты (неостигмин, эзерин) ингибируют ацетилхолинэстеразу, тем самым они усиливают действие ацетилхолина. Еще более мощными ингибиторами фермента являются органические фторфосфаты. Они образуют прочную связь с ацетилхолинэстеразой и вызывают смерть от остановки дыхания. Это нервнопаралитические яды — табун, зарин.
121. Биохимия нервной ткани. Тормозные медиаторы. Пептидные синапсы. Особенности энергетического обмена нервной ткани. Бнттмпсоэонт
Тормозные медиаторы
Главным тормозным медиатором в нервной системе является гамма-аминомасляная кислота ^ГАМК). ГАМК увеличивает проницаемость постсинаптических мембран для К+. В результате отдаляется мембранный потенциал от порогового уровне, при котором возникает потенциал действия. Инактивация ГАМК осуществляется путем трансминирования.
Глицин — тормозной медиатор в спинном мозге и в большинстве структур ствола мозга. Торможение осуществляется в результате повышения проводимости постсинаптической мембраны для СГ, тo приводит к ее гиперполяризации.
Пептидные синапсы Энкефалины и эндорфины
Эндорфины - это родовое название эндогенных опиоидных пептидов. Эти пептиды назвали опиоидными из-за способности связываться с теми же рецепторами, которые связывают морфин и др. опиаты. Первыми были открыты два пентапептида, названные энкефашшами: мет-энкефалин и лей-энкефалин (остальные 4 аминокислоты одинаковые). Они, по-видимому, участвуют в интеграции сенсорной информации, имеющей отношение к боли.
В гипоталамусе позже были обнаружены более длинные пептиды а-, Р-, у-эвдорфины, которые оказались в 12-100 раз активнее энкефалинов. Эти пептиды участвуют в регуляции эмоциональных ответов, вырабатываются также при мышечной работе. Имеющиеся данные позволяют предполагать, что эндорфины и энкефалины могут синтезироваться в нервной ткани, в надпочечниках. Особый интерес к этим соединениям связан с надеждой найти анальгетики, к которым не возникает привыкания.
Энкефалины играют важную роль в регуляции функционального состояния ЦНС, сердечно-сосудистой системы, пищеварительной и других. Энкефалины оказывают гепатопротекторное действие. При действии энкефалинов секреторная функция печени, желудка, подже‘ лудочной железы, как правило, снижается, поэтому можно полагать, что физиологическая роль энкефалинов, находящихся в крови, заключается в угнетении секреторной активности регулируемых органов.
Установлена взаимосвязь между содержанием опиоидных пептидов и тяжестью ишемии при инфаркте миокарда. Инфаркт миокарда сопровождается повышением уровня опиоидных пептидов не только в ткани миокарда и в крови, но и в различных структурах мозга и надпочечниках. Показано, что опиоидные пептиды обладают антиишемической активностью за счет угнетения процесса перекисного окисления липидов и стабилизации мембран кардиомиоцитов, наибольшей антиишемической активностью обладает p-эндорфин, меньшей - лейэнкефалин. Одним из главных механизмов реализации антиишимического действия считается ингибирующее влияние опиоидных пептидов на активность симпатикоадреналовой системы.
В клинике используют синтетический аналог лей-энкефалина, препарат даларгин, у больных ИБС, при инфаркте миокарда.
Интенсивность энергетического метаболизма в нервной ткани значительно выше, чем в других тканях. У человека мозг составляет около 2 % от массы тела и потребляет приблизительно 20% всей энергии, расходуемой организмом в покое. Характерной'особен-ностью энергетического обмена головного мозга является высокая в сравнении с другими тканями интенсивность потребления кислорода и глюкозы из крови, поэтому ухудшение условий доставки кислорода кровью приводит к нарушениям энергетики и функции мозга.
Высокая скорость окислительных и энергетических реакций характерна не для всей нервной ткани. Периферические нервы используют приблизительно в 30 раз меньше кислорода, чем эквивалентное по массе количество ткани из центральной нервной системы (ЦНС). В головном мозге прослеживается дифференци-рованность в интенсивности дыхания различных мозговых образований. По мере перехода от филогенетически более молодых передних отделов мозга к филогенетически более старым задним отделам интенсивность дыхания снижается. По скорости поглощения кислорода отделы мозга можно расположить в следующей убывающей последовательности: кора больших полушарий > мозжечок и промежуточных мозг > средний и продолговатый мозг > спинной мозг.
Важной особенностью, отличающей энергетический метаболизм в мозге от других тканей, является невозможность замены основного субстрата окисления - глюкозы другими соединениями, интенсивно окисляющимися во многих тканях. Это обусловлено низкой проницаемостью гематоэнцефалического барьера (ГЭБ) у взрослых животных для свободных жирных кислот, кетоновых тел, аминокислот. У растущих особей, когда еще происходит формирование ГЭБ, в мозг могут поступать кетоновые тела й свободные жирные кислоты, уровень которых в крови в ранний постнатальный период высок. Однако, несмотря на возможность проникновения в мозг кетоновых тел, их вклад в энергетический баланс несравнимо ниже, чем у глюкозы.
Несмотря на доминирующее значение окислительных процессов в нервной ткани, существует динамическое равновесие между дыханием и анаэробным гликолизом. Это подтверждает постоянное присутствие в нормальных условиях в мозге определенного количества лактата. Существование такой базальной активности анаэробного гликолиза., способной в любой момент резко активизироваться и в определенней степени компенсировать потерю способности к окислению, имеет немаловажное значение, обеспечивая нервные клетки энергией в неблагоприятных и несвойственных им гипоксических условиях.
С учетом того, что более 90% метаболизируемой в мозге глюкозы подвергается аэробному окислению по гликолитическому пути с последующим окислением в цикле трикарбоновых кислот (ЦТК), последний играет особую роль в энергетическом обеспечении ЦНС. Пополнение пула ацетил-КоА для цитратсинтазной реакции ЦТК может происходить при окислении свободных жирных кислот, кетоновых тел, метаболизме некоторых аминокислот. Однако эти пути наработки ацетил-КоА, имеющие большое значение для многих тканей, в мозге взрослых животных играют незначительную роль. Главным механизмом ввода углеродного скелета пируват в ЦТК служит окислительное декарбоксилирование под действием пируватдегидрогеназного комплекса (ПДК), который в мозговой ткани преобладает над реакциями карбоксилирования, катализируемыми пируваткарбоксилазой и НАДФ-зависимой малатдегидрогеназой. При длительном голодании, тяжелых формах диабета, тиреотоксикозе увеличивается использование в ткани головного мозга кетоновых тел в качестве источника ане" тил-КоА с последующей утилизацией в ЦТК. Однако, даже в таких экстремальных условиях за счет окисления кетоновых тел и свободных жирных кислот покрывается не более 20% энергетических потребностей мозга. Таким образом, можно заключить, что энергетический обмен головного мозга находится в тесной взаимосвязи с уровнем функциональной активности нервной ткани. При существовании общих закономерностей энергетического обеспечения, пластического обмена и функций различных клеток организма, имеется определенная специфика течения этого процесса в головном мозге. Она выражается, прежде всего, в чрезвычайно большой скорости обмена веществ, малых количествах энергетических ресурсов, полной в силу этого зависимости от притока крови к ткани мозга и очень большой чувствительности к гипоксии. Энергия при функционировании мозга в основном затрачивается на химическую работу по синтезу различных органических соединений и на работу по формированию ионных концентрационных градиентов, необходимых для создания мембранных потенциалов и генерации потенциалов действия. Эти превращения и соответствующие им энергозатраты лежат в основе всех разнообразных и сложнейших функций мозга, включая обработку сенсорной информации, мышление и память.
122. Функциональная биохимия почек, особенности метаболизма, функции почек. Образование мочи, понятие о пороговых веществах. Фбпомфпомпопв
. Функции почек
1. Обезвреживающая:
в почках происходит обезвреживание чужеродных веществ путем образования парных соединений с глицином, уксусной и глюкуроновой кислотами, а также окисление некоторых органических спиртов и др. веществ. Общее обезвреживание NH3 путем образования аммонийных солей.
2. Мочеобразовательная и экскреторная:
- удаление конечных продуктов метаболизма (мочевины, креатинина, уратов, сульфатов, фосфатов и др.)
3. Регуляторно-гомеостатическая:
- поддержание водно-электролитного, кислотно-основного баланса, осмотического давления и объема внеклеточной жидкости.
4. Метаболическая:
- глюконеогенез, - дезаминирование аминокислот. Дезаминирование аминокислот координировано с глюконеогенезоМ, т.к. при этом освобождается углеродный скелет, необходимый Д®1 синтеза глюкозы.
5 Эндокринная:
-продукция ренина (см. ренин - ангиотензиновая система).
-продукция эритропоэтина.
Эритропоэтин — полипептидный гормон, в основном образуется в почках и печени. Основное место биосинтеза эритропоэтина во взрослом организме - почки, а у эмбриона - печень. Эритропоэтин синтезируется интерстециальными клетками корковой части почки. Вместе с другим фактором, так называемым «колонийстимулирующим фактором» (КСФ), этот гормон контролирует дифференцировку стволовых клеток костного мозга.
Секреция эритропоэтина стимулируется при гипоксии (р02|). В многочисленных экспериментах с изолированной почкой показано, что почка содержит сенсоры, реагирующие на изменения концентрации кислорода. В условиях гипоксии количество 'циркулирующего в плазме эритропоэтина возрастает примерно в 1000 раз. В течение нескольких часов гормон обеспечивает превращение недифференцированных клеток костного мозга в эритроциты, и концентрация эритроцитов в крови увеличивается. Нарушение функции почек ведет к снижению секреции эритропоэтина и заболеванию анемией. В настоящее время почечная анемия может быть компенсирована за счет эритропоэтина, получаемого методами генной инженерии.
- синтез 1,25-дигидрохолекальциферола
- катаболизм гормонов (паратгормона, инсулина)
Образования мочи
Образование мочи происходит в структурно-функциональных единицах почки - нефронах. В почке человека содержится около 1 Млн. нефронов. Морфологически нефрон представлен сосудистым клубочком и окружающей его капсулой, проксимальным канальцем,' петлей Генле, дистальным канальцем, впадающим в собирательную трубочку.
Моча образуется в результате трех процессов - фильтрации, реабсорбции и секреции. Почечный клубочек.
Через базальную мембрану клубочков свободно фильтруется вода и низкомолекулярные соединения с массой до 50 кДа. Движущей силой фильтрации является разность гидростатического давления в капиллярах клубочка и в полости капсулы. Фильтрат (первичная моча) по составу и концентрации низкомолекулярных веществ не отличается от плазмы крови. На величину клубочковой фильтрации влияет целый Ряд факторов.
Почечные факторы, влияющие на величину клубочковой фильтрации:
- величина гидростатического давления крови в капиллярах клубочка;
- количество функционирующих клубочков (почечные клубочки подчиняются общему закону резервации);
- величина давления ультрафильтрата в капсуле клубочка;
- степень проницаемости капилляров клубочка (при некоторых заболеваниях проницаемость капилляров настолько повышается, что через клубочковый фильтр проходит белок и форменные элементы крови).
Внепочечные факторы, влияющие на величину клубочковой фильтрации:
-величина кровяного давления в магистральных сосудах (аорта, почечная артерия);
-скорость почечного кровотока; -величина онкотического давления крови;
-функциональное состояние других выделительных органов;
-степень гидратации тканей (количество воды в тканях).
Проксимальный отдел канальца - происходит активная и пассивная реабсорбция компонентов первичной мочи в кровь.
Активно реабсоубируются белки, пептиды, аминокислоты, мочевая кислота, глюкоза, Na+ , К+, Са2~, Mg2+, фосфат и сульфаты.
Пассивно: вода, бикарбонаты, хлориды, мочевина. В просвет проксимальных канальцев активно секретируются Н+, антибиотики, красители, пассивно — аммиак.
Степень реабсорбции Na+, а с ним и воды (всасывается около 2/3) контролируется альдостероном, калий всасывается полностью. Реабсорбция Са2* и фосфатов контролируется паратгормоном.
Дистальный отдел канальца продолжает активную реабсоубиию Na+, Са2+, Mg2+ и пассивную реабсорбиию воды, хлоридов и мочевины. Здесь также происходит активная секреиия Н+ и К+ и пассивная - NНз+. Регулирует всасывание воды вазопресин.
Внутрипочечные факторы, влияющие на величину реабсорбции:
- скорость протекания первичной мочи по системе почечных канальцев;
- реабсорбционная способность почечного эпителия, которая изменяется под действием различных веществ, в частности, гормонов;
- количество непороговых веществ в первичной моче.
Внепочечные факторы, влияющие на величину реабсорбции:
- состояние эндокринной системы организма, особенно наличие гормонов, усиливающих обмен веществ (инсулин, тироксин) и влияющих на реабсорбционную способность канальциевого эпителия (АДГ, альдостерон);
- водно-солевой баланс организма; - количество непороговых веществ в крови
123. Почечная недостаточность, проявления, причины, признаки. Почечные камни, виды. Нормальные и патологические компоненты мочи. пнппппквнипкм
Выделяют острую и хроническую почечную недостаточность.
Острая почечная недостаточность
- Пререналъная — обусловлена снижением кровоснабжения почек —► снижена скорость клубочковой фильтрации, а функция почечных канальцев сохранена.
- Интраренальная - обусловлена множеством причин, но все они приводят к некрозу почечных канальцев. Клубочки страдают реже, СКФ снижена из-за вазоконстрикции. Патогенез не ясен.
Постренальная — обусловлена препятствием оттока мочи. Если состояние сохраняется длительно —► вторичное повреждение почечных канальцев
Хроническая почечная недостаточность
Обусловлена снижением количества функционирующих нефронов, что приводит к:
- нарушению концентрирования и разведения мочи
- нарушению гомеостаза электролитов и ионов водорода (ацидоз)
- задержке выводимых продуктов метаболизма (уремия)
-нарушению метаболизма витамина D (остеодистрофия)
- сниженному синтез эритропоэтина (анемия).
Признаки почечной недостаточности
Лабораторно:
1. Азотемия как результат снижения клубочковой фильтрации (в качестве уремических токсинов выступают производные гуанидина - метилгуанидин и гуанидинпировиноградная кислота, а также производные фенола — индол, скатол и др.); 2. Протеинурия, гипо- и диспротеинемия как следствие ускоренного катаболизма протеинов, вторичная гиперлипопротеинемия IV типа; снижение концентрации мочи; признаки метаболического ацидоза;
3. Анемия, обусловленная торможением эритропоэза при одновременном ускоренном гемолизе эритроцитов;
4. Признаки активации внутрисосудистого свертывания или вторичная гиперкоагулемия; рост агрегационной и адгезивной активности тромбоцитов.
Одним из наиболее часто встречающихся клинико-лаборатоных синдромов при заболеваниях почек является нефротический синдром.
Клинические проявления:
• Выраженная протеинурия (более 3,5 г/л в сутки)
• Гипоальбуминемия (менее 30 г/л)
• Г иперлипидемия
• Отеки
Основные причины почечных отеков:
1. Снижение онкотического давления (из-за потери белка - нефротический синдром)
2. Повышение проницаемости сосудистой стенки (вследствие повышения активности гиалуронидазы и снижения содержания кальция в крови — острый гломерулонефрит)
3. Вторичный гиперальдостеронизм (вследствие задержки электролитов и воды)
В клинике ни одна из причин не проявляется как самостоятельная, а лишь преобладает в том или ином случае.
Почечные камни
Обычно состоят из продуктов обмена веществ, в норме имеющихся в первичной моче в концентрациях, близких к величинам их максимальной растворимости. Незначительные изменения состава мочи могут- вызвать осаждение этих соединений в ткани почек в виде кристаллов или камней.
Условия, способствующие образованию камней:
1. Высокая концентрация в моче одного или нескольких компонентов клубочкового фильтрата. Это может быть связано или с уменьшением объема мочи или с чрезмерно высокой скоростью экскреции образующих камни продуктов обмена.
2. Изменение pH мочи, способствующее образованию осадков различных солей.
3. Застой мочи вследствии нарушения мочеотделения.
4. Отсутствие соответствующих ингибиторов. Предполагается, что моча в норме содержит ингибиторы роста кристаллов оксалата Са2+. В моче больных, у которых систематически образуются кальциевые камни, такие ингибиторы отсутствуют.
Виды мочевых камней
1.Содержащие кальций. Составляют 70-90% всех почечных камней, состоят из оксалата или фосфата кальция. Гиперкальциурия способствует образованию кальциевых осадков, а вид соли зависит от pH мочи, наличия в системе оксалатов или фосфатов. Гиперкальциурия бывает при остеопорозе, при длительном ацидозе, когда усиливается ионизация солей Са, при гипервитаминозе D.
Усиленная экскреция оксалатов способствует образованию оксалата кальция, нерастворимого даже при нормальном содержании Са2+ в моче. Причиной повышенного уровня оксалатов может быть потребление определенных продуктов питания, гипервитаминоз С. Щелочная среда способствует образованию кальциевых осадков. При высоких значениях pH осаждаются преимущественно фосфаты Са2+, оксалатные камни образуются при любых значениях pH.
2. Камни, состоящие из мочевой кислоты. Составляют примерно 10% всех почечных камней. Осаждению уратов способствует кислая моча. В большинстве случаев непосредственную причину возникновения камней выявить не удается.
3. Цистиновые камни.
4. Ксантиновые камни. Эти виды камней встречаются редко при врожденных заболеваниях цистинурии или ксантинурии.








