2. Эндоцитоз комплекса ЛПНП – рецептор в клетку.
3. Расщепление лизосомальными ферментами апоВ до аминокислот, эфиров холестерина до холестерина и жирной кислоты.
4. Возвращение молекулы рецептора на поверхность клетки.
Рецепторы захвата ЛПНП :
Поступивший холестерин клетка использует для построения мембран. Такой рецепторно-опосредованный путь поступления холестерина в клетку предохраняет ее от перегрузки холестерином, т.к.:
1) ингибируется фермент синтеза холестерина – ГМГ-КоА-редуктаза;
2) подавляется синтез рецепторов для ЛПНП.
3) активируется ацил-КоАхолестеринацилтрансфераза (АХАТ), которая переводит свободный холестерин в запасную форму – эфиры холестерина;
Нерегулируемые пути поступления холестерина в клетку:
1) неспецифический эндоцитоз через скэвенджер рецепторы;
2) рецепторный путь с помощью рецепторов, не имеющих высокой специфичности к отдельным апопротеинам;
3) путь физико-химического обмена холестерином между мембраной клетки и ЛПНП.
Эти пути транспорта холестерина могут привести к накоплению холестерина в клетке.
Обратный транспорт холестерина
Это транспорт холестерина из клеток периферических тканей (в том числе и из сосудистой стенки) в составе ЛПВП в печень. ЛПВП синтезируются в печени в виде дисков, богатых лецитином и апопротеинами АI, АII (насцентные ЛПВП). Кроме того, подобные частицы образуются в капиллярах во время липолиза ХМ и ЛПОНП.
Перенос холестерина из клеток на дисковидные частицы ЛПВП (насцентные ЛПВП) происходит по градиенту концентрации. При контакте ЛПВП с клеткой апоАI связывает свободный холестерин мембраны клетки. Фермент лецитинхолестеринацилтрансфераза (ЛХАТ), находящийся на поверхности ЛПВП, присоединяет остаток жирной кислоты из лецитина (в составе ЛПВП) к свободному холестерину. Образуется гидрофобная молекула эфира холестерина, которая перемещается в центр диска ЛПВП. При этом освобождаются участки поверхности апоАI для связывания новых молекул свободного холестерина из мембраны клетки. Вновь происходит эстерификация холестерина, в результате частица ЛПВП из диска превращается в сферическую молекулу и в такой форме захватывается рецепторным путем печенью. В печени холестерин, поступивший в составе ЛПВП, используется для биосинтеза желчных кислот и в конечном итоге выводится из организма.
Вывод: холестерин в клетку поступает с ЛПНП (прямой транспорт), а удаляется с ЛПВП – обратный транспорт холестерина.
Синтез холестерина
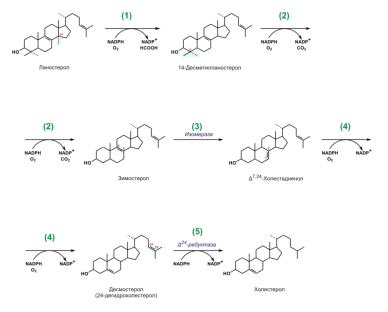
Ланостерин превращается в мембранах гладкого эндоплазматического ретикулума в холестерин. Метильная группа при С14 окисляется, и образуется 14-десметилланостерин. 2. Затем удаляются ещё два метила при С4, и образуется зимостерол. 3. Далее двойная связь C8=С9 перемещается в положение С8=С7 и образуется Δ7,24-холестадиенол. 4. Двойная связь далее перемещается в положение С5=С6,образуется десмостерол. 5. После чего в боковой цепи восстанавливается двойная связь, и образуется холестерин. (Восстановление двойной связи в боковой цепи может, однако, происходить и на предшествующих стадиях биосинтеза холистерола)
59. Основные источники и пути использования Ацетил-КоА. Основные патологические процессы, связанные с нарушениями превращений Ацетил-КоА (голодание, ожирение, атеросклероз, желчно-каменная болезнь, диабет). Оиипиакоппсснпак стр 192, 206,
ОБМЕН И ФУНКЦИИ АМИНОКИСЛОТ
60. Переваривание белков. Всасывание аминокислот. Динамическое состояние белков в организме. Азотистый баланс. Биологическая ценность пищевых белков и нормы белков в питании. Регуляция пищеварения гормоноподобными веществами. Пбвадсбвоаббцпбинбвпрпгв
Переваривание белков происходит в различных отделах пищеварительного тракта (в желудке, двенадцатиперстной кишке и тонком кишечнике) под действием протеолитических ферментов пищеварительных соков. Переваривание белков начинается в желудке под действием Ферментов желудочного сока. В сутки выделяется от 1,5 до 2,5л сока, который отличается от других пищеварительных соков сильно кислой реакцией. рН его 0,9-1,6 благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка. Секреция соляной кислоты в полость желудка представляет активный транспорт, осуществляемый протонной АТФ-азой с затратой АТФ и благодаря наличию в клетках карбоангидразы. Процесс сопровождается уменьшением количества хлоридов в крови. Роль соляной кислоты: 1. вызывает денатурацию белков; 2. вызывает набухание труднорастворимых белков; 3. растворяет белки, растворимые в кислой среде; 4. активирует пепсиноген; 5.создает рН, необходимое для действия пепсина; 6.стерилизует пищу; 7. способствует всасыванию железа; 8. вызывает секрецию секретина в двенадцатиперстной кишке. В желудочном соке содержатся протеолитические ферменты: пепсин, гастриксин, реннин. Главным из них является пепсин. Переваривание белков в кишечнике. Образовавшиеся в результате действия пепсина в желудке полипептиды и нерасщепившиеся белки поступают в двенадцатиперстную кишку, куда поступает и сок поджелудочной железы. Панкреатический сок имеет щелочную реакцию(рН 7,5-8,2), что обусловлено высоким содержанием бикарбонатов. В сутки выделяется до 800 мл сока. Кислое содержимое, поступающее из желудка, нейтрализуется, и пепсин теряет свою активность. В панкреатическом соке содержатся протеолитические ферменты: трипсин, химотрипсин, арбоксипептидаза и эластаза, которые вырабатываются в виде проферментов. Переваривание сложных белков начинается с отщепления простетической группы, которая в зависимости от химической природы подвергается дальнейшим ферментативным превращениям (например, нуклеиновые кислоты расщепляются панкреатическими РНК-азой и ДНК-азой). Белковая часть гидролизуется рассмотренными выше ферментами до аминокислот. Всасывание аминокислот происходит путем активного транспорта, т.е. идет с затратой АТФ, против градиента концентрации с участием переносчиков. Выяснено, что существуют специфические транспортные системы, переносящие аминокислоты определенного строения: 1.Нейтральные с небольшим радикалом. 2.Нейтральные с объемным радикалом. 3.Кислые (отрицательно заряженные). 4.Основные (положительно заряженные). 5.Пролин. В настоящее время расшифрован механизм транспорта аминокислот в клетки кишечника, мозга, почек, получивший название γ-глутамильного цикла. В нем участвуют 6 ферментов и трипептид глутатион. Ключевой фермент – гаммаглутамилтрансфераза (ГГТ) локализован в мембране. Он отщепляет глутаминовую кислоту от глутатиона и переносит ее поступающую в клетку аминокислоту с образованием дипептида. Он оказывается в клетке и расщепляется другим ферментом цикла. аминокислоту и оксопролин. Через ряд реакций оксопролин превращается в глутаминовую кислоту. Из нее, цистеина и глицина, выделившихся при расщеплении глутатиона, происходит ресинтез глутатиона, при этом на активацию каждой аминокислоты затрачивается АТФ,т.е. на ресинтез глутатиона – 3 АТФ. Судьба аминокислот. Аминокислоты, всосавшиеся через стенку кишечника,поступают в кровь и по системе воротной вены попадают в печень, где используются с различными целями. Главные пути использования следующие: 1Синтез структурных белков. 2Синтез белков плазмы крови. -Синтез биологически активных веществ (ферментов, пуриновых и пиримидиновых нуклеотидов, аминов, креатина). 3Распад аминокислот с использованием углеродного скелета для глюконеогенеза. 4Значительная часть аминокислот с кровью поступает к органам и тканям. В тканях аминокислоты используются с такими же целями,кроме этого, в эндокринных железах синтезируются гормоны. В тканях, как и в печени, происходит распад аминокислот до СО2, Н2О и ΝН3. О состоянии обмена белков в организме судят по азотистому балансу, т.е. разнице между количеством азота,поступающего в организм,и количеством азота, выводимого из организма( с мочой и калом) в виде конечных продуктов обмена. Возможны три состояния азотистого баланса. Положительный азотистый баланс- состояние, при котором количество поступающего азота превышает количество выводимого из организма. Такое состояние характерно для детского возраста (у растущих организмов), беременности, периода выздоровления людей после перенесенных тяжелых заболеваний, спортсменов в период интенсивной тренировки. При таком состоянии азотистого баланса синтетические процессы превалируют над процессами распада белков органов и тканей. Отрицательный азотистый баланс- состояние, при котором количество азота, выделяемого из организма, превышает количество азота, принимаемого с пищей в течение суток.Оно встречается при голодании (частичном или полном), белковой недостаточности, тяжелых раневых и инфекционных заболеваниях, в норме в старческом возрасте. Старики, как правило, теряют в весе, хотя в организм может поступать достаточное количество белков. Азотистое равновесие - состояние, при котором количество вводимого с пищей азота равно количеству азота, выводимого из организма. Оно характерно для здорового взрослого человека,находящегося на полноценной диете. Природные белки в связи с разным аминокислотным составом имеют разную пищевую ценность.Чем ближе аминокислотный состав пищевого белка к аминокислотному составу белков человека,тем выше его биологическая ценность. Такими биологически ценными белками для человека являются белки мяса, молока, яиц. Исключение хотя бы одной незаменимой аминокислоты из пищи приводит к отрицательному балансу, остановке роста и развития, прекращению синтеза белков. Недостаточное поступление одной незаменимой аминокислоты ведет к неполно усвоению других аминокислот, а в последующем также может привести к остановке роста и тяжелым расстройствам.Растительные белки от животных отличаются другим соотношением аминокислот, и поэтому для удовлетворения потребностей человека в белках их требуется значительно больше. Важное значение в удовлетворении потребностей нашего организма в белках имеет способность белков пищи к усвоению, что зависит от способности протеолитических ферментов наших пищеварительных соков расщеплять их до аминокислот. Так, белки шерсти, перьев, волос имеют близкий аминокислотный состав к белкам человека,но не гидролизуются протеолитическими ферментами пищеварительных соков человека большинства животных.
Регуляция пищеварения гормоноподобными веществами желудочно-кишечного тракта. Секреция пищеварительных соков находится под контролем сложных нейрогуморальных механизмов, среди которых важное место занимают гормоноподобные вещества желудочно-кишечного тракта. Секрецию желудочного сока стимулируют гастрин и гистамин. Гастрин – полипептид, вырабатываемый слизистой оболочкой привратника под действием пищи,попадающей в желудок.Секреция его, кроме химических факторов, стимулируется рефлекторным растяжением желудка пищей. Кровотоком гастрин доставляется в клетки слизистой желудка и стимулирует секрецию желудочного сока (воды, электролитов, ферментов). Гистамин – продукт декарбоксилирования гистидина– вызывает интенсивную секрецию желудочного сока, чем обусловлено его применение в клинике при исследовании функциональной активности слизистой желудка. Регуляция секреции панкреатического сока осуществляя секретином и холецистокинином. Оба они – полипептиды, синтезируемые слизистой оболочкой двенадцатиперстной кишки. При поступлении из желудка кислого содержимого стимулируется образование секретина(под влиянием соляной кислоты и других химических раздражителей).Он поступает с кровотоком в поджелудочную железу аденилатциклазную систему стимулирует секрецию ,богатогоска бикарбонатами и с большим содержанием воды. В ответ на поступление в двенадцатиперстную кишку жирной пищи клетками слизистой оболочкой вырабатывается холецистокинин,который кровью доставляется в поджелудочную железу и стимулирует выработку сока, богатого ферментами (поэтому его раньше называли панкреозимин). Он также вызывает сокращение гладких мышц желчного пузыря .Усиливает двигательную функцию кишечника.
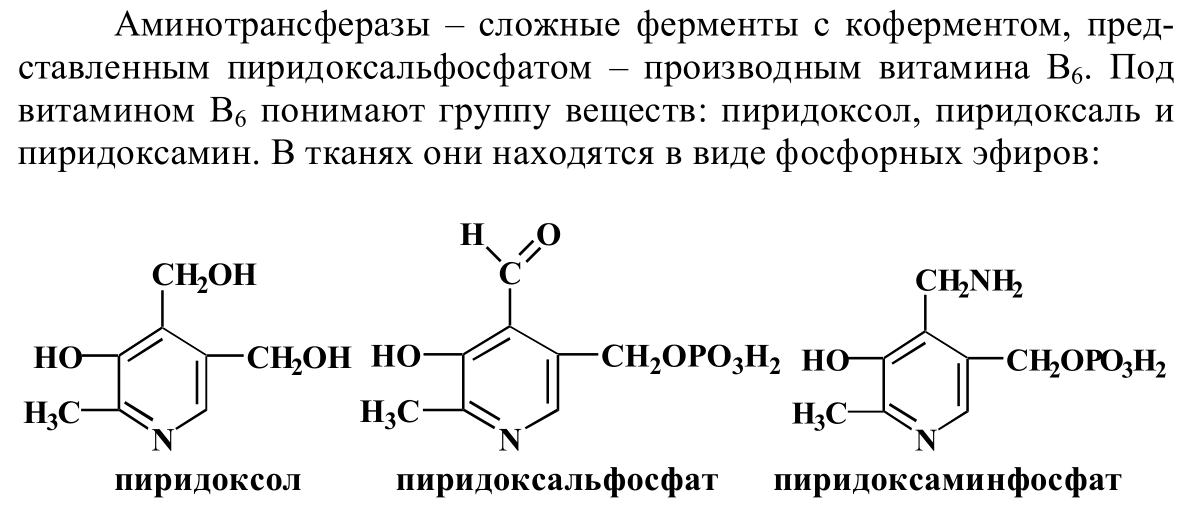
61. Трансаминирование аминокислот: химизм, значение. Характеристика трансаминаз. Непрямое дезаминирование аминокислот. Тахзхтнда стр 258-
Процесс аминирования протекает в несколько стадий:
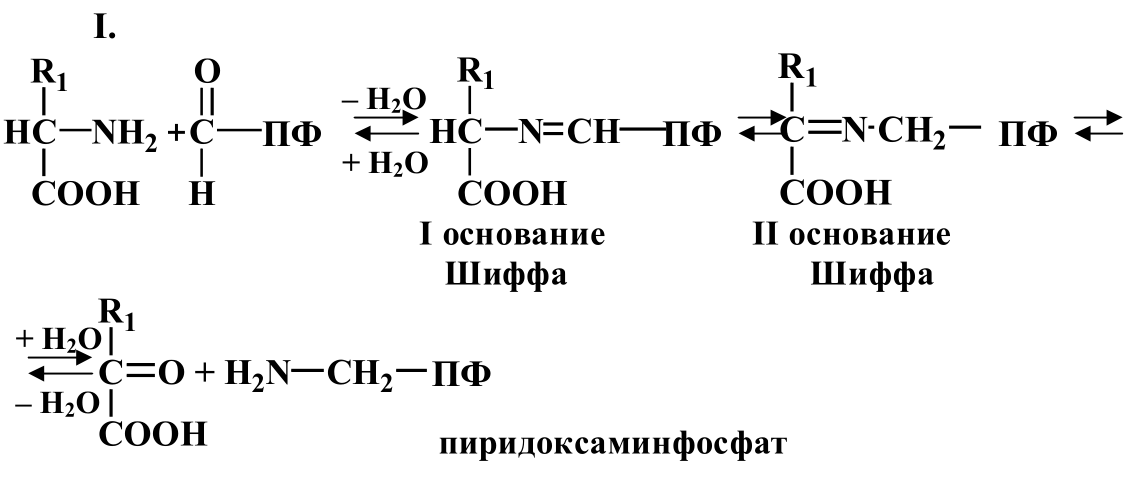
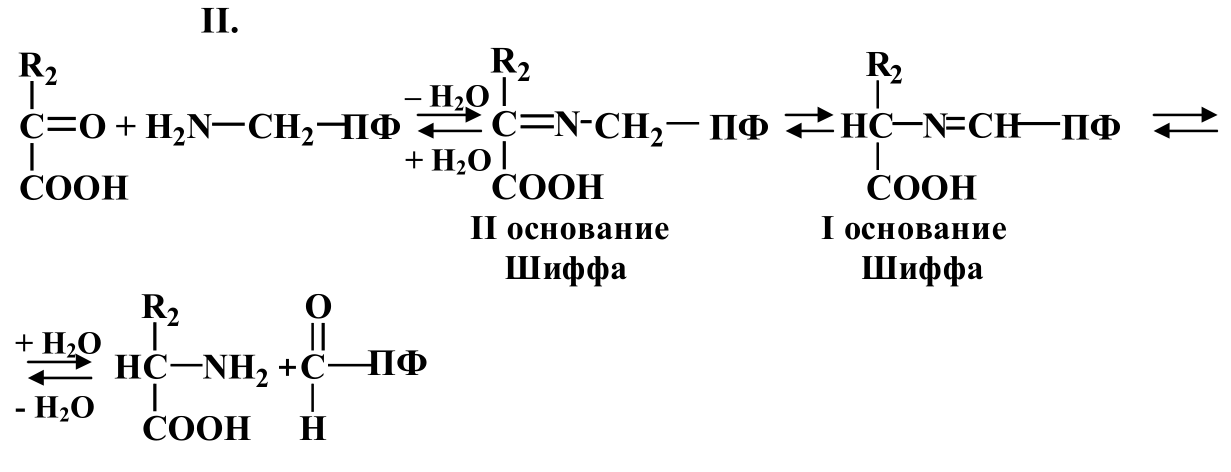
Значение процесса переаминирования:
1)Путь синтеза в организме заменимых аминокислот.
2)Первый этап непрямого дезаминирования аминокислот.
3)Осуществление взаимосвязи аминокислот, углеводов и липидов
В тканях активно дезаминируется лишь глутаминовая кислота. Изучение азотистого обмена,активности ферментов привело к мысли что дезаминирование большей части аминокислот идет непрямым путем.Вначале аминокислоты вступают в переаминирование с кето-кислотами: ПВК,ЩУК или a-кетоглутаровой. Образовавшиеся АЛА и АСП вновь вступают в переаминирование с а-кетоглутаровой кислотой при участии специфических ферментов АлАТ или АсАТ.
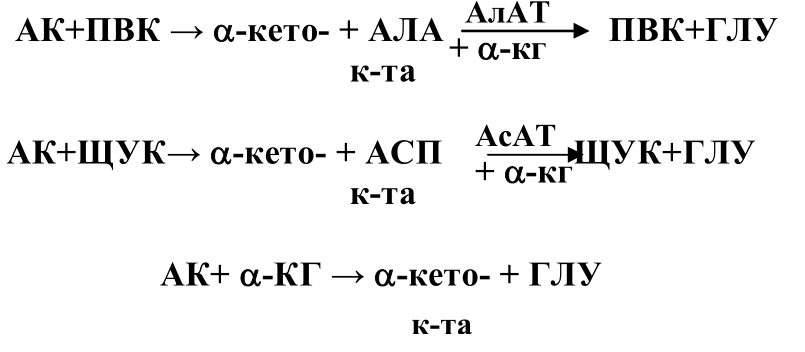

62. Окислительное дезаминирование аминокислот: химизм, характеристика ферментов. Восстановительное аминирование альфа-кетоглутарата, значение. Глюкозо-аланиновый цикл. Одаххфваакзгац
3. . Дезаминирование аминокислот. У животных, растений и большинства бактерий дезаминирование происходит окислительным путем. Процесс идет с участием ферментов оксидаз.Выделены оксидазы L-аминокислот, превращающие L-изомеры аминокислот, и D-оксидазы.L-оксидазы имеют простетическую группу ФМН,проявляют относительную и стереохимическую специфичность,мало активны (т.к. опт. рН=10- 10% активности, локализованы в пероксисомах.D-оксидазы сложные флавиновые ферменты с простетической группой ФАД, проявляет относительную и стереохимическую специфичность, высокоактивны, находятся в микросомах.
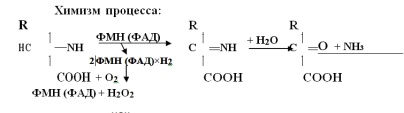
Аминокислоты наших белков и поступающих с пищей– L-ряда. D-аминокислоты могут поступить с некоторыми бактериями или всо-саться из кишечника, где под действием рацемаз микрофлоры может идти рацемизация L-аминокислот в D-изомеры. Из всех L-оксидаз следует выделить фермент глутаматдегидрогеназу, которая дезамини-рует глутаминовую кислоту и отличается тем, что: 1. Имеет кофермент НАД. Обладает абсолютной специфичностью. 2.Высоко активна. 3.Локализована в митохондриях. 4Регуляторный фермент: активируется АДФ, ингибируется АТФ, ГТФ, эстрогенами, тироксином. При дезаминировании глутаминовой кислоты образуетсяa-кетоглутарат. Вывод: таким образом, из всех нашихL-аминокислот активно прямо дезаминируется только глутаминовая кислота.
Восстановительное аминирование альфакетоглутарата.
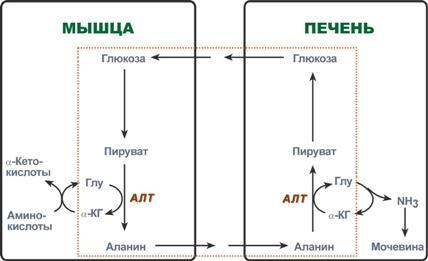
В мышечной ткани этот процесс приводит к образо-ванию еще одной транспортной формы аммиака. При интенсивной мышечной работе выделяющийся аммиак связываетсяa - с кетоглутаровой кислотой под действием глутаматдегидрогеназы.
Образуется глутамат:

Глутаминовая кислота вступает в переаминирование с пируватом, образующимся при интенсивной мышечной работе в результате распада гликогена или глюкозы. Образующийся аланин является транспортной формой аммиака, доставляемой кровью в печень, где он вступает в переаминирование aс-кетоглутаратом, в результате чего получаются пируват и глутамат. Глутаминовая кислота через аспартат (пе-реаминирование со щавелевоуксусной кислотой)включает свою NН2-группу в мочевину. Пируват используется в глюконеогенезе для синтеза глюкозы, которая поставляется печенью мышцам. Этот механизм имеет важной значение для выведения аммиака из мышечной ткани и получил название глюкозо-аланинового цикла.
63. Декарбоксилирование аминокислот. Образование биогенных аминов, их роль в регуляции метаболизма. Обезвреживание аминов. Даобаирврмоа
Стр 248
Декарбоксилирование - Превращения аминокислот по карбоксильной группе. В тканях животных процесс декарбоксилирования аминокислот протекает под действием декарбоксилаз с образованием аминов.  Декарбоксилазы аминокислот – сложные ферменты, коферментом которых является пиридоксальфосфат. Обнаружены процессы декарбоксилирования гистидина, триптофана, 5-гидрокситриптофана, тирозина, глутаминовой, аспарагиновой, цистеиновой кислот с образованием соответствующего амина: гистамина, триптамина, серотонина, тирамина, γ-аминомасляной кислоты, β-аланина, таурина. Их называют биогенными аминами, так как в малых дозах это биологически активные вещества с мощным фармакологическим действием, в больших дозах – фармакологические яды. Декарбоксилазы ароматических аминокислот, гистидина, глютаминовой кислоты и других не отличаются строгой специфичностью. Ферменты мало активны, и процесс протекает с малой скоростью. При декарбоксилировании тирозина образуется тирамин, проявляющий сосудосуживающее действие.
Декарбоксилазы аминокислот – сложные ферменты, коферментом которых является пиридоксальфосфат. Обнаружены процессы декарбоксилирования гистидина, триптофана, 5-гидрокситриптофана, тирозина, глутаминовой, аспарагиновой, цистеиновой кислот с образованием соответствующего амина: гистамина, триптамина, серотонина, тирамина, γ-аминомасляной кислоты, β-аланина, таурина. Их называют биогенными аминами, так как в малых дозах это биологически активные вещества с мощным фармакологическим действием, в больших дозах – фармакологические яды. Декарбоксилазы ароматических аминокислот, гистидина, глютаминовой кислоты и других не отличаются строгой специфичностью. Ферменты мало активны, и процесс протекает с малой скоростью. При декарбоксилировании тирозина образуется тирамин, проявляющий сосудосуживающее действие.

Декарбоксилирование триптофана сопровождается образованием триптамина, также обладающего сосудосуживающим действием.

При декарбоксилировании производного триптофана - 5- гидрокситриптофана образуется 5- гидрокситриптамин или серотонин.

Серотонин преимущественно образуется в нервной ткани и кишечнике. Обладает сильным сосудосуживающим действием, является нервным медиатором, поддерживает нормальную психическую деятельность, участвует в центральной регуляции артериального действия, температуры тела, дыхания, в почечной фильтрации, способствует развитию аллергической реакции, токсикоза беременности. Декарбоксилирование гистидина приводит к образованию гистамина.

Декарбоксилирование гистидина гистидиндекарбоксилазой происходит главным образом в тучных клетках, которые имеются в соединительной ткани (практически во всех органах). Гистамин накапливается и хранится в этих клетках в соединении с белками в специальных секреторных гранулах и может освобождаться и выделяться в кровь при разнообразных механических воздействиях (травма, ожог, электрическое раздражение), действии эндогенных веществ. Физиологическое действие гистамина на сосуды отличается от действия других биогенных аминов: он расширяет сосуды и поэтому снижает кровяное давление. В большом количестве гистамин образуется в месте травмы, в очаге воспалительного процесса, вызывает расширение сосудов, повышает проницаемость капилляров, способствует выходу лейкоцитов, развитию воспалительной реакции. Является медиатором нервных процессов, медиатором боли. Укусы насекомых (комары, клопы, осы и др.) вызывают зуд, боль, отечность, что связано с выделением гистамина. Гистамин стимулирует секрецию желудочного сока и слюны (поэтому его используют в клинике при исследовании секреторной функции желудка - гистаминовый завтрак). Если слизистая желудка на введение гистамина не усиливает секрецию сока, то это свидетельствует о повреждении секреторных клеток - атрофическом гастрите. Гистамин сокращает гладкие мышцы легких, что проявляется приступом удушья. Гистамин способствует сенсибилизации организма и развитию аллергических реакций. Обезвреживание гистамина происходит путем его метилирования с образованием 1-метилгистамина, который выводится с мочой. При α-декарбоксилировании глутаминовой кислоты образуется γ-аминомасляная кислота.

ГАМК в большом количестве содержится в сером веществе мозга, в то время как в белом веществе мозга и периферической нервной системе ее почти нет. Является тормозным фактором в нервных клетках. В опытах с изолированной петлей кишечника показано, что ГАМК вызывает прекращение перистальтики даже в присутствии ацетилхолина, стимулирующего перистальтику. Используется в клинике при лечении заболеваний центральной нервной системы, связанных с резким возбуждением коры головного мозга (эпилепсия). Цистеин окисляется в цистеиновую кислоту, которая в тканях животных декарбоксилируется с большой скоростью с образованием таурина. 
Таурин используется в реакциях конъюгации с желчными кислотами для увеличения их гидрофильности. Непосредственное декарбоксилирование цистеина, протекающее в организме с небольшой скоростью, сопровождается образованием цистеамина.

Цистеамин оказывает защитное действие при лучевой болезни, однако его действие является непродолжительным, поэтому были синтезированы его производные, аналоги, которые нашли применение в терапии лучевых поражений. В животных тканях с большой скоростью протекает декарбоксилирование 3,4-диоксифенилаланина - производного фенилаланина. При этом образуется ДОФ-амин, оказывающий мощное сосудосуживающее действие. ДОФ-амин является промежуточным продуктом в синтезе катехоламинов норадреналина и адреналина.
64. Источники аммиака в организме. Местное обезвреживание аммиака. Глюкозо-аланиновый цикл. Значение процессов. Иавомоагацзп стр 242
Обезвреживание аммиака в организме. Различают механизмы местного и общего обезвреживания аммиака. Местное обезвреживание сводится к временному связыва-нию аммиака с образованием его транспортных форм,в составе ко-торых он доставляется к органам, где происходит общее обезвреживание. Последнее заключается в образовании инертных,ненужных организму соединений, которые выводятся с мочой.
Местное обезвреживание аммиака Осуществляется в тканях(мозг, мышцы, сетчатка и др.), где происходит непосредственное образование NН3, по нескольким ме-ханизмам. 1. Главным путем обезвреживания аммиака является его связы-вание с глутаминовой (у животных) и аспарагиновой (больше у рас-тений) кислотами, т.е. их амидирование. Протекает в мышечной ткани, мозгу, печени, почках с затратой АТФ.Катализируется глута-минсинтетазой, локализованной в ЭПС. Образовавшиеся глутамин и аспарагин являются главными транспортными формами аммиака, в виде которых он доставляется в печень и почки, где происходит общее обезвреживание. Глутамин и аспарагин являются и главными резервными формами аммиака ..
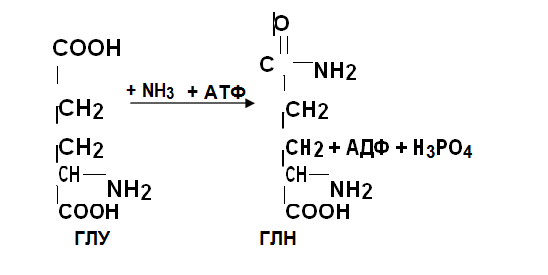
2.Обезараживание аммиака в тканях происходит также путем амидирования остатков глутаминовой и аспарагиновой кислот в бел-ках.
3.Восстановительное аминирование (ретрансаминирование) a-кетоглутарата. В мышечной ткани этот процесс приводит к образованию еще одной транспортной формы аммиака. Аммиак связывается с кетоглутаровой кислотой под действием глутаматдегидрогеназы. Образуется глутамат. Глутаминовая кислота вступает в переаминирование с пируватом, образующимся при интенсивной мышечной работе в результате распада гликогена или глюкозы.Образующийся аланин является транспортной формой аммиака, доставляемой кровью в печень, где он вступает в переаминирование aс-кетоглутаратом, в результате чего получаются пируват и глутамат. Глутаминовая кислота через аспартат включает свою NН2-группу в мочевину. Пируват используется в глюконеогенезе для синтеза глюкозы, которая поставляется печенью мышцам. Этот ме-ханизм имеет важной значение для выведения аммиака из мышечной ткани и получил название глюкозо-аланинового цикла.

65. Общее обезвреживание аммиака: синтез мочевины и аммонийных солей, значение процессов. Ооасмиасзп стр 242,245, 247
Общее обезвреживание аммиака Происходит в печени и почках, где образуются инертные соединения, которые выводятся с мочой. В печени синтезируется мочевина, в почках – аммонийные соли.
Синтез мочевины
Синтез мочевины представляет собой циклический процесс, открытый Г.Кребсом в 1932 году. В печень с кровотоком поступают транспортные формы аммиака глутамин и аланин, и ,по воротной вене аммиак, всосавшийся в кишечнике. Глутамин под действием глутаминазы распадается на глутаминовую кислоту и аммиак. В митохондриях гепатоцитов из аммиака, СО2 с затратой АТФ под действием карбамоилфосфатсинтетазы (1) синтезируется карба-моилфосфат.

Карбамоилфосфат взаимодействует с орнитином при участии орнитинкарбамоилтрансферазы (2) с образованием цитруллина.
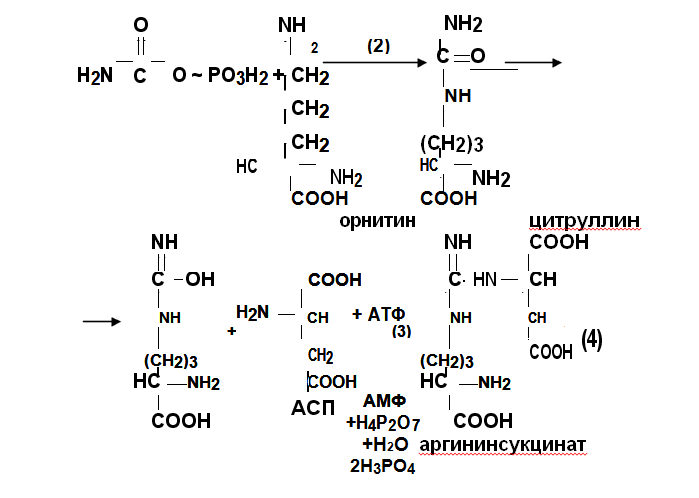
Цитруллин вступает в конденсацию с аспарагиновой кислотой под действием аргининсукцинатсинтетазы (3) с затратой АТФ. Об-разуется аргининянтарная кислота, которая аргининсукцинатлиазой
66.
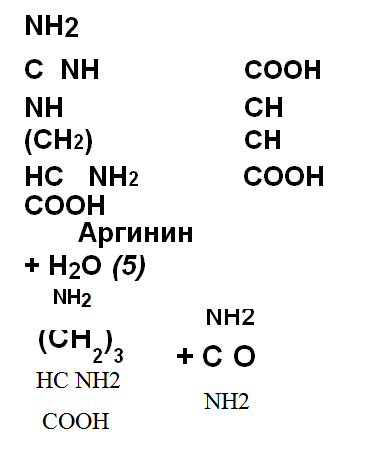
(4) расщепляется на аргинин и фумаровую кислоту. Аргинин расщепляется аргиназой (5) на орнитин и мочевину, которая простой диффузией выходит из клеток в кровь и выделяется с мочой. В сутки в норме выделяется от 20 до 40г мочевины. Фумаровая кислота является промежуточным продуктом цикла трикарбоновых кислот и фумаратгидратазой превращается в малат, который окисляется малатдегидрогеназой в щавелевоуксусную –кислоту. Оксалацетат вступает в реакцию переаминирования с глута-миновой кислотой и превращается в аспарагиновую,которая вновь используется в синтезе мочевины. Образовавшийся из глутамата α-кетоглутарат вступает в реакцию переаминирования с любыми аминокислотами печени.
Глутамин, доставляемый кровотоком в почки,расщепляется глутаминазой, активируемой протонами и самим глутамином,на глутаминовую кислоту и аммиак. Аммиак взаимодействует с прото-нами, образуя ион аммония, который соединяется с анионами раз-личных кислот: фосфорной, серной, угольной, соляной, щавелевой, мочевой.
NН3 + Н+ → NН4+
Образуются соли аммония– фосфаты, сульфаты, карбонаты, хлориды, оксалаты, ураты, которые выводятся с мочой. Всего в сутки у здорового человека выделяется 1-1,2 г таких солей.
67.
Процесс имеет важное значение, т.к. является не только меха-низмом общего обезвреживания аммиака, но участвует в поддержа-нии кислотно-щелочного равновесия в организме, а также сберегает от выведения с мочой катионы натрия и калия.
68. Трансметилирование. Метионин и S-аденозилметионин (участие в синтезе креатина, адреналина, фосфатидилхолина, метилировании чужеродных соединений). Участие тетрагидрофолиевой кислоты в метилировании. Тмиаутквм стр 258
Трансметилирование – это транспорт метильной группы от источника метильных групп к субстрату метилирования с помощью доноров или переносчиков метильных групп. Источниками метильных групп служат серин, холин, бетаин. Переносчиками или донорами метильных групп для субстратов служат активная форма фолиевой кислоты – тетрагидрофолиевая кислота (ТГФК) и активная формметионина – S-аденозилметионин
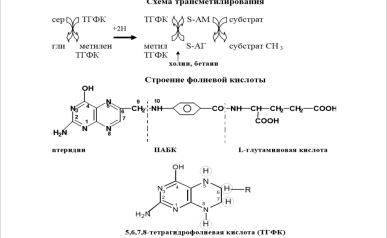
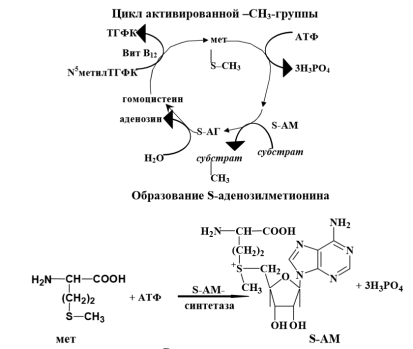
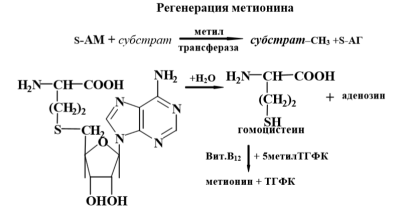
Примеры реакций метилирования
1.Синтез креатина идет в 2 стадии. В почках и поджелудочной железе образуется гуанидин-ацетат:
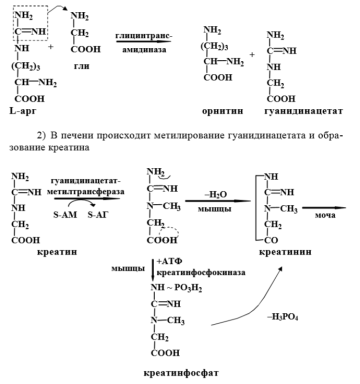
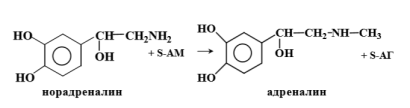
Инактивация катехоламинов происходит двумя путями – дезаминированием с участием МАО и метилированием с участием катехол-О-метилтрансферазы. 3. Синтез фосфатидилхолина.
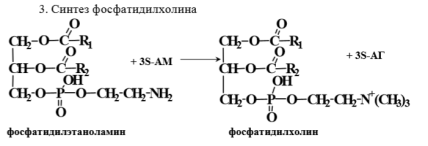
Фосфатидилхолин необходим для построения мембран, в печени – для образования липопротеинов очень низкой плотности и липопротеинов высокой плотности. При дефиците фосфатидилхолина в печени накапливаются нейтральные жиры и развивается жировой гепатоз.
69. Обмен фенилаланина и тирозина. Использование тирозина для синтеза катехоламинов, тиреоидных гормонов, меланинов. Распад тирозина до фумаровой и ацетоуксусной кислот. Наследственные нарушения обмена фенилаланина и тирозина. Офититдсктгмртдфиакннофит стр 262
РЕГУЛЯЦИЯ ОБМЕНА ВЕЩЕСТВ. ГОРМОНЫ
70. Иерархия регуляторных систем. Место гормонов в системе регуляции метаболизма и функций органов. Классификация гормонов по химическому строению и механизму действия. Ирсмгвсрмифокгпхсимд
Стр 371, 377, 379








