Гиперлипопротеинемия I типа
Очень редкий тип гиперлипопротеинемии. Характеризуется высоким содержанием в плазме крови хиломикронов (один из видов липопротеинов) и триглицеридов. Уровень холестерина может быть нормальным или несколько повышенным. При стоянии крови больного в холодильнике, через сутки над прозрачной плазмой образуется сливкообразный слой, состоящий из хиломикронов.
При этой форме болезни содержание липидов резко усиливается после употребления жирной пищи и снижается после строгой диеты. У больных (иногда с детства) наблюдаются боли в животе и повторяющееся воспаление поджелудочной железы (панкреатит). Заболевание начинает проявляется в возрасте до 10 лет. Для этого типа гиперлипопротеинемии развитие атеросклероза не характерно.
Гиперлипопротеинемия II типа
Это наиболее частая форма заболевания – около 30 % случаев гиперлипопротеинемий. Характеризуется повышением содержания холестерина липопротеинов низкой плотности ЛПНП. В зависимости от наследственных факторов, болезнь может обнаружиться как в детском возрасте, так и старше 30 лет.
Внешне наблюдаются характерные жировые опухоли желтоватого цвета (ксантомы) в области ахиллова сухожилия, сухожилий разгибателей стоп и кистей. Нередко отмечаются признаки раннего атеросклероза, описаны случаи смерти от инфаркта миокарда в детском и юношеском возрасте.
Гиперлипопротеинемия II типа подразделяется на типы IIa и IIb в зависимости от содержания триглицеридов:
Гиперлипопротеинемия типа IIa : может быть как врожденной, так и возникнуть в результате неправильного питания. Наследственная форма проявляется жировыми опухолями (ксантомами) и ранним развитием сердечно-сосудистых заболеваний. Уровень триглицеридов в норме. Встречается достаточно редко.
Гиперлипопротеинемия типа IIb : характеризуется повышенным содержанием триглицеридов в крови. Распространенная форма болезни.
Гиперлипопротеинемия III типа
Весьма редкая наследственная форма гиперлипопротеинемии, которая проявляется увеличением содержания хиломикрон (один из видов липопротеинов) и липопротеинов промежуточной плотности. Заболевание проявляется в детском возрасте. Характерными признаками являются желтовато-коричневые отложения жиров в коже ладонных линий, жировые опухоли (ксантомы) в области сухожилий, ожирение. Часто наблюдаются ожирение печени и повышенное содержание мочевой кислоты в крови. У многих больных развивается сахарный диабет. У больных обнаруживают различные проявления атеросклероза: ишемическую болезнь сердца, поражение сосудов ног.
Гиперлипопротеинемия IV типа
Самый распространённый тип гиперлипопротеинемии (около 70% всех случаев), связанный с нарушением обмена триглицеридов. Гиперлипопротеинемия IV типа обнаруживается лишь в среднем возрасте. Усиливается после приема углеводов и алкоголя. Нередко её появление связано с наличием в семье больных сахарным диабетом. Для болезни характерно увеличение печени в результате отложения жиров. У многих больных развивается атеросклероз и ишемическая болезнь сердца, иногда у пациентов возникает ожирение.
Гиперлипопротеинемия V типа
Гиперлипопротеинемия V типа очень редкое расстройство, выявляемое в подростковом возрасте или у молодых лиц. Проявляется в возрасте старше 20 лет; у больных отмечают ожирение, жировые опухоли (ксантомы), нередко боли в животе. Иногда выявляется скрытый или умеренно выраженный сахарный диабет. Ишемическая болезнь сердца наблюдается реже, чем при гиперлипопротеинемиях IIa, III и IV типа.
Биохимия атеросклероза
Атеросклероз – это патология, характеризующаяся появлением атерогенных бляшек на внутренней поверхности сосудистой стенки. Одна из основных причин развития такой патологии – нарушение баланса между поступлением холестерола с пищей, его синтезом и выведением из организма. У пациентов, страдающих атеросклерозом, повышены концентрации ЛПНП и ЛПОНП. Существует обратная зависимость между концентрацией ЛПВП и вероятностью развития атеросклероза. Это согласуется с представлениями о функционировании ЛПНП как переносчиков ХС в ткани, а ЛПВП – из тканей.
Базовой метаболической «предпосылкой» развития атеросклероза является гиперхолестеролемия. (повышенное содержание холестерола в крови). Гиперхолестеролемия развивается:
- вследствие избыточного поступления ХС, углеводов и жиров;
- генетической предрасположенности, заключающейся в наследственных дефектах структуры рецепторов ЛПНП или апоВ-100, а также в повышенном синтезе или секреции апоВ-100 (в случае семейной комбинированной гиперлипидемии, при которой в крови повышены концентрации и ХС и ТАГ).
Важную роль в механизмах развития атеросклероза играет модифицирование ЛП. Изменения нормальной структуры липидов и белков в составе ЛПНП делает их чужеродными для организма и поэтому более доступными для захвата фагоцитами. Модифицирование ЛП может происходить по нескольким механизмам:
- гликозилирование белков, происходящее при увеличении концентрации глюкозы в крови;
- перекисная модификация, приводящая к изменениям липидов в липопротеинах и структуры апоВ-100;
- формирование аутоиммунных комплексов ЛП-антитело (изменённые ЛП могут становиться причиной образования аутоантител).
Модифицированные ЛПНП поглощаются макрофагами. Этот процесс не регулируется количеством поглощенного ХС, как в случае его поступления в клетки через специфические рецепторы, поэтому макрофаги перегружаются ХС и превращаются в «пенистые клетки», которые проникают в субэндотелиальное пространство. Это приводит к формированию липидных пятен или полосок в стенке кровеносных сосудов. На этой стадии эндотелий сосудов может сохранять свою структуру. При увеличении количества пенистых клеток происходит повреждение эндотелия. Повреждение способствует активации тромбоцитов. В результате они секретируют тромбоксан, который стимулирует агрегацию тромбоцитов, а также начинают продуцировать тромбоцитарный фактор роста, стимулирующий пролиферацию гладкомышечных клеток. Последние мигрируют из медиального во внутренний слой артериальной стенки, способствуя таким образом росту бляшки. Далее происходит прорастание бляшки фиброзной тканью, клетки под фиброзной оболочкой некротизируются, а ХС откладывается в межклеточном пространстве. На последних стадиях развития бляшка пропитывается солями кальция и становится очень плотной. В области бляшки часто образуются тромбы, перекрывающие просвет сосуда, что приводит к острому нарушению кровообращения в соответствующем участке ткани и развитию инфаркта.
Биохимические основы лечения атеросклероза.Важным лечебным фактором, снижающим риск развития гиперхолестеролемии и атеросклероза, является гипокалорийная и гипохолестериновая диета, Поступление ХС с пищей не должно превышать 300 мг/сут. К лечебным и профилактическим факторам относят обогащение пищи полиеновыми жирными кислотами, уменьшающими риск тромбообразования и способствующими выведению ХС из организма. Витамины С, Е, А, обладающие антиоксидантными свойствами, ингибируют ПОЛ, поддерживая тем самым нормальную структуру ЛПНП и их метаболизм.
Меры по коррекции диеты недостаточны при лечении выраженной гиперхолестеролемии и атеросклерозе. В этом случае лечение, как правило, комплексное. Один из принципов лечения – размыкание цикла энтерогепатической циркуляции жёлчных кислот. Для этого используют лекарства типа холистерамина – полимера, который в кишечнике адсорбирует жёлчные кислоты и выводится с фекалиями, уменьшая таким образом возврат жёлчных кислот в печень. В печени при этом увеличивается захват ХС из крови для синтеза новых жёлчных кислот.
Наиболее эффективные препараты, применяемые при лечении атеросклероза, – ингибиторы ГМГ-КоА-редуктазы. Такие препараты могут практически полностью подавить синтез собственного ХС в организме. В этих условиях печень также увеличивает захват ХС из крови.
+Лекарственные препараты – фибраты – ускоряют катаболизм ЛПОНП, активируя ЛП-липазу. Эти препараты усиливают также окисление жирных кислот в печени, уменьшая тем самым синтез ТАГ и эфиров холестерола и, как следствие, секрецию ЛПОНП печенью. Клофибрат индуцирует синтез ферментов пероксисом, способных окислять жирные кислоты. Фибраты обычно применяют при сочетании гипертриглицеролемии и гиперхолестеролемии. Для эффективного лечения атеросклероза применяют, как правило, комбинированное воздействие нескольких лекарственных препаратов.
57. Биосинтез триацилглицеринов, глицерофосфолипидов: химизм, роль фосфатидной кислоты, физиологическое значение. Бтгхрфкфз
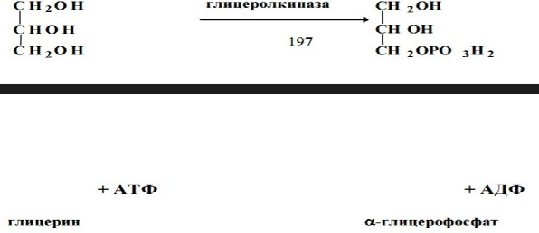
Триацилглицерины синтезируются во многих органах и тканях, но наиболее важную роль в их синтезе играют печень, стенка кишечника, лактирующая молочная железа и жировая ткань. Для синтеза необходима активная форма глицерина – a-глицерофосфат и активная форма жирной кислоты – ацил-КоА. Активация глицерина может происходить двумя способами:
1. В стенке кишечника и почках, печени есть активная глицеролкиназа:
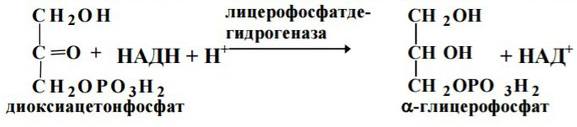
2. В жировой ткани и мышцах активность этого фермента очень низкая и образование a-глицерофосфата связано с гликолизом:
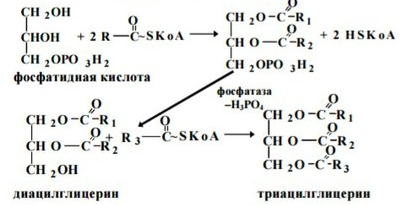
a-Глицерофосфат, образованный любым из этих путей, взаимодействует с двумя молекулами активированных жирных кислот (ацил-КоА) с образованием фосфатидной кислоты:
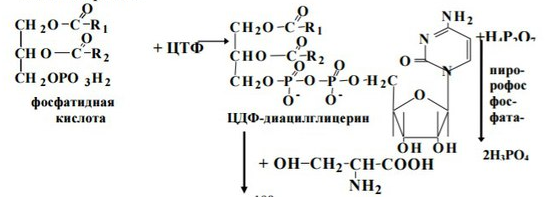
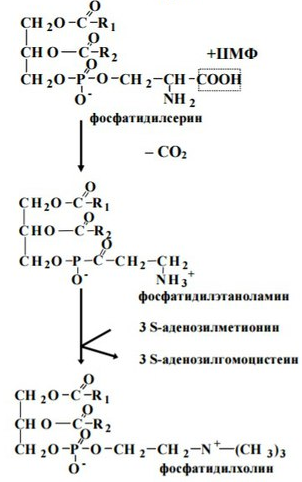
6. Синтез глицерофосфолипидов
Биосинтез глицерофосфолипидов наиболее интенсивно происходит в печени, стенке кишечника, семенниках, молочной железе. Реакции синтеза локализованы в эндоплазматической сети. Синтез до образования фосфатидной кислоты происходит также, как и синтез триацилглицеринов.
58. Обмен и функции холестерина, прямой и обратный транспорт. Биосинтез холестерина: химизм, регуляция. Оифхпиотбххр
Обмен холестерина
Функции холестерина:
1) входит в состав клеточных мембран,
2) из него образуются другие физиологически важные соединения: желчные кислоты, кортикостероидные и половые гормоны, витамин Д. Условно в организме человека можно выделить три пула холестерина: А – быстрообменивающийся (около 30 г холестерина); В – медленнообменивающийся (около 50 г холестерина); С – очень медленнообменивающийся (около 60 г холестерина). К первому пулу А следует отнести холестерин печени и других паренхиматозных органов, а также холестерин кишечной стенки и плазмы крови. Обновление холестерина этого пула происходит в среднем за 30 сут (1 г/сут). К третьему пулу (пул С) можно отнести холестерин головного и спинного мозга, нервов и холестерин соединительной ткани. Скорость обновления холестерина в белом веществе мозга исчисляется годами. Холестерин остальных органов и тканей составляет промежуточный медленнообменивающийся пул В.
За сутки в организме человека около 500 мг холестерина окисляется в желчные кислоты, примерно такое же количество экскретируется с фекалиями, около 100 мг удаляется со слущивающимся эпителием кожи и секретом сальных желез и менее 100 мг используется на образование стероидных (половых и кортикоидных) гормонов. Таким образом, ежесуточный расход холестерина составляет около 1,2 г, и он черпается из быстрообменивающегося пула А. Для того, чтобы восполнить эту потерю, организм синтезирует в сутки около 800 мг холестерина и примерно 400 мг получает с пищей. 2. Транспорт холестерина Прямой транспорт холестерина. Это транспорт холестерина в клетку в составе ЛПНП. Основное место синтеза холестерина – печень, в остальные органы и ткани он поступает в составе ЛПНП. В 1985 году американцы Браун и Гольдстейн за раскрытие механизма захвата ЛПНП клетками получили Нобелевскую премию. Они открыли на поверхности клеток рецепторы, высокоспецифичные к апопротеину В, а это – основной белок ЛПНП.
Поступление холестерина в клетку включает следующие этапы:
1.Связывание ЛПНП с рецепторами.








