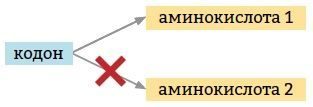
4. Однозначность. Один кодон может кодировать только одну аминокислоту.
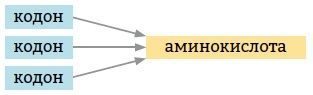
5. Вырожденность. Одна аминокислота может кодироваться несколькими разными кодонами.
6. Универсальность. Генетический код одинаков для всех живых организмов.
Пример. Нам дана последовательность кодирующей цепи:
3’– CCGATTGCACGTCGATCGTATA– 5’.
Матричная цепь будет иметь последовательность:
5’– GGCTAACGTGCAGCTAGCATAT– 3’.
Теперь «синтезируем» с этой цепи информационную РНК:
3’– CCGAUUGCACGUCGAUCGUAUA– 5’.
Синтез белка идет в направлении 5’ → 3’, следовательно, нам нужно перевернуть последовательность, чтобы «прочитать» генетический код:
5’– AUAUGCUAGCUGCACGUUAGCC– 3’.
Теперь найдем старт-кодон AUG:
5’– AU AUG CUAGCUGCACGUUAGCC– 3’.
Разделим последовательность на триплеты:

Найдем стоп-кодон и согласно таблице генетического кода запишем последовательность аминокислот:

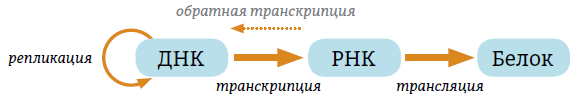
Центральная догма молекулярной биологии звучит следующим образом: информация с ДНК передается на РНК (транскрипция), с РНК – на белок (трансляция). ДНК также может удваиваться путем репликации, и также возможен процесс обратной транскрипции, когда по матрице РНК синтезируется ДНК, но такой процесс в основном характерен для вирусов.
31. Биосинтез белков. Основные компоненты белок-синтезирующей системы. Синтез аминоацил-т-РНК. Субстратная специфичность аминоацил-т-РНК-синтетаз. Биологический код. Биосинтез белков: механизм и последовательность реакций при синтезе полипептидной цепи.
32. Регуляция действия генов. Индукция и репрессия синтеза белков в организме человека. Роль гормонов в регуляции действия генов. Лекарственные препараты - ингибиторы матричных синтезов у прокариот и эукариот.
МЕМБРАНЫ
33. Общая характеристика и функции мембран, компоненты мембран. (стр 65-76)
34. Модели строения мембран, трансмембранный транспорт. (см. стр77-89)
ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
35. Биологическое окисление и пути использования кислорода. Боипик
Биологическое окисление – это совокупность всех окислительных процессов, протекающих в организме с участием О2.
Назначение биологического окисления:
1) Тканевое дыхание.
2) Разрушение или обезвреживание ксенобиотиков.
3) Биосинтезы.
4) Изменение проницаемости мембран, окислительная модификация молекул
36. Строение митохондрий и структурная организация цепей переноса электронов.
Митохондрии – “энергетические станции” клеток. Предполагается, что во внутренней мембране митохондрий содержится система ферментов – протонных насосов, приводимых в действие переносом электронов по дыхательной цепи. Используя энергию, выделяющуюся при переносе электронов, насосы выкачивают протоны из матрикса в ММП. В результате наружная сторона мембраны получает (+) заряд. В матриксе митохондрий образуется избыток ОН–, т.е. внутренняя сторона (-). Таким образом на внутренней мембране митохондрий создается и градиент электрического потенциала – возникает ЭХП. Избыток протонов из ММП стремится вернуться в матрикс по градиенту концентрации. Поскольку мембрана для них непроницаема, они двигаются по специальному протонному каналу АТФ-синтазы. Именно этот поток протонов и служит движущей силой для синтеза АТФ.
Различают 3 рода субстратов:
1. Углеводородные (сукцинат, ацил-КоА). Средняя энергия окисления пары электронов этих субстратов 150 кДж/моль. Они окисляются ФАД-зависимыми дегидрогеназами, т.е. в укороченной дыхательной цепи.
2. Спиртовые (лактат). Средняя энергия отщепления пары электронов = 200 кДж/моль. Окисляются НАД-зависимыми дегидрогеназами, т.е. в полной дыхательной цепи.
3. Альдегидные (3-фосфоглицериновый альдегид), энергия отщепления пары электронов 250 кДж/моль. При их окислении образуется не только НАДН, но и часть энергии используется для синтеза высокоэнергетических соединений.
37. Типы окисляемых субстратов. НАД-зависимые дегидрогеназы. ФАД-зависимые дегидрогеназы: сукцинатдегидрогеназа и ацил-КоА-дегидрогеназа. Тоснздфздсиакд стр112
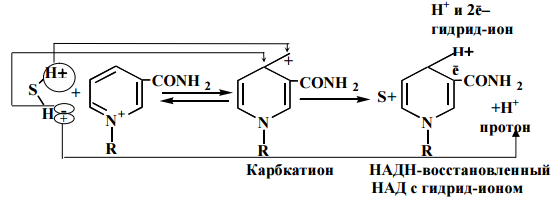
Субстрат, отдав гидрид-ион НАД+ а протон в среду, окислился. НАД+ присоединив гидрид-ион, восстановился. Восстановленный НАД отщепляется от своего апофермента и подходит к внутренней мембране митохондрий, где окисляется вторым участником полной дыхательной цепи.
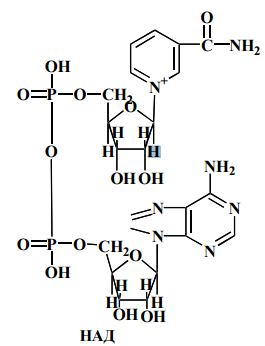
38. Внутренняя мембрана митохондрий и дыхательная цепь: НАДН-дегидрогеназа, убихинон, их структура и механизм переноса протонов и электронов. Вммидцндуисимппиэ
Убихинон или кофермент Q (quinone – Q – уби-вездесущий) найден практически во всех клетках. Это жирорастворимый хинон с длинной изопреноидной боковой цепью. Это единственный переносчик в цепи, не являющийся белком, он легко двигается в липидном слое мембраны. Убихинон выполняет коллекторную функцию, собирая восстановительные эквиваленты не только от НАДН-дегидрогеназ (полная дыхательная цепь), но и от ФАД-зависимых дегидрогеназ (укороченная дыхательная цепь).
Строение убихинона, механизм окисления
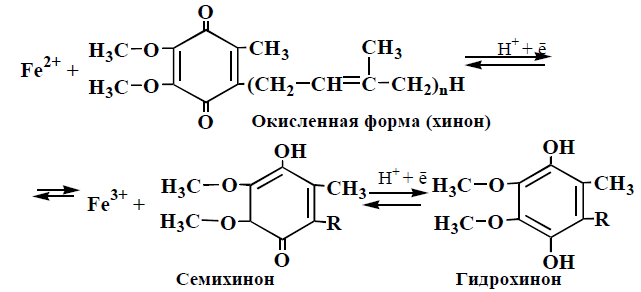
Убихинон может присоединять 1 электрон к своему О2 от Fe2+, кислород становится электроотрицательным и присоединяет протон из матрикса, образуется семихинон. Однако убихинон может присоединять и 2 электрона, т.е. участвовать в двухэлектронном переносе, образуя гидрохинон.
Когда электроны от железосерных центров ФМН-зависимых дегидрогеназ переходят на убихинон, ФМН-зависимые дегидрогеназы окисляются, убихинон восстанавливается. Подчеркнем, что убихинон от восстановленных НАДН-дегидрогеназ присоединяет только электроны через железосерные центры. Протоны, которые присоединились к убихинону, происходят из матрикса (возможно из внутренней мембраны митохондрий).
39. Внутренняя мембрана митохондрий и дыхательная цепь: цитохромы, их структура и механизм переноса протонов и электронов на кислород. Вммидццисимппиэнк
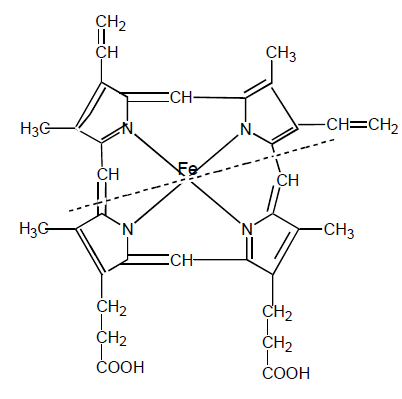
Цитохромы это железосодержащие белки, окрашенные в красный или коричневый цвет. Они относятся к гемпротеинам, т.е. Fe входит в структуру гема. Они способны переносить электроны. Существуют 3 класса цитохромов: а, в, с, различающихся по спектрам поглощения. В дыхательной цепи они располагаются в порядке возрастания редокс- потенциала:
в → с1 → с→ аа3→ О2
В ходе переноса электронов атом Fe находится то в восстановленной форме Fe2+, то в окисленной – форме Fe3+. Группа гема, как и FeS-центра переносит только 1 электрон в отличие от НАД, флавина и убихинона, переносящих по 2 электрона. Таким образом, восстановленный убихинон переносит свои 2 электрона на две молекулы цитохрома “в”. Fe в цитохроме “в” восстанавливается, убихинон окисляется, протоны убихинона выталкиваются в ММП.
Цитохромы отличаются друг от друга строением
гема, способом связи гема с белковой частью. Простетической группой цитохромов “в”, “c”, “c1” служит протопорфирин IX (гем), как в миоглобине и гемоглобине, цитохромы а и а3 имеют другую железопорфириновую группу, называемую гем “а”.
Связь гема с белковой частью цитохромов происходит по 5 и 6 координационным связям Fe
Цитохром “в” Гис - Гис “с” Гис - мет, ковалентная связь винильных групп гема с цис “а” NН2 аминосахара - О2, НСN, СО
Все цитохромы прочно встроены в мембрану, исключением является цитохром “c”, который может свободно двигаться в плоскости мембраны, подобно убихинону.
Перенос электронов на О2 цитохромоксидазой. Цитохромы “а” и “а3” являются конечными звеньями дыхательной цепи. Они существуют в виде комплекса – цитохромоксидаза. Она содержит две молекулы гема “a” и 2 атома Cu. Цитохромоксидаза может необратимо ингибироваться цианидами, угарным газом. Она имеет очень высокое средство к кислороду. Это позволяет дыхательной цепи функционировать с максимальной скоростью до тех пор, пока в ткани не будет практически исчерпан О2.
Цитохромоксидаза забирает 1 электрон от цитохрома “c”. Вначале электрон переносится на окисленное Fe3+ гема “a”, образуется восстановленное Fe2+. Электрон с Fe2+ дальше переносится на окисленную Cu2+. В результате Fe окисляется, а Cu восстанавливается в Cu1+. Сu1+ отдает 1 электрон на О2. При этом Cu окисляется, О2 – восстанавливается. Однако для восстановления О2 нужно 4 электрона, а группы гема являются переносчиками одного электрона. Каким образом четыре электрона “сходятся” для восстановления молекулы О2, пока не установлено.
О2+4е+4Н+→2Н2О
Присоединение электрона к О2 сопровождается присоединением протонов, которые возвращаются в матрикс из ММП через канал АТФ- синтазы.
40. Окислительное фосфорилирование, коэффициент Р/О. Гипотезы механизма окислительного фосфорилирования. Офкгмоф
Синтез АТФ из АДФ и фосфорной кислоты, который происходит с использованием энергии, освобождающейся при окислении веществ и сопряжен с переносом электронов по дыхательной цепи, называется окислительным фосфорилированием.
Коэффициент окислительного фосфорилирования (К) – это отношение количества неорганического фосфата, потребляемого в процессе дыхания, к количеству кислорода: Р/0, т.е. К показывает число молей АТФ, образующихся из АДФ и Рн на 1 грамм-атом поглощенного О2. Предложен в 1939г. В.А. Белицером. Экспериментально установлено, что для субстратов, окисляющихся в полной дыхательной цепи (яблочная, пировиноградная, изолимонная кислоты) этот коэффициент равен 3.
1. Гипотеза химического сопряжения. Предложена Липманом, Слейтером, Ленинджером. Она рассматривает окислительное фосфори-лирование по аналогии с субстратным фосфорилированием.
Механизм синтеза АТФ на 1 участке сопряжения:
НАДН + ФМН→ ФМН2 + НАД+
НАДН + X→НАД+ +ХН2
ХН2 + Н3Р04→X•Н2•Н3Р04
X•Н2•Н3РО4 + ФМН→ФМН•Н2 + X~Н3Р04
X~Н3Р04 + АДФ→X + АТФ
Макроэрг передается на АДФ и образуется АТФ. ЕОК→ЕМАКР→ЕАТФ
Сторонники этой гипотезы помещают в участки сопряжения гипотетические вещества, которые забирают протоны и электроны от первого участника пункта сопряжения и взаимодействуют с Н3Р04. В момент отдачи протонов и электронов второму участнику пункта сопряжения, связь с фосфатом становится макроэргической.
Недостаток: до сих пор не открыли эти соединения.
2. Механохимическая или конформационная (Грин, Бойер, 60-е годы). Согласно этой гипотезе в процессе переноса протонов и электронов изменяется конформация белков-ферментов. Они переходят в новое конформационное состояние, а затем при возвращении в исходную конформацию отдают энергию для синтеза АТФ: ЕОК→ ЕКОНФ.СДВИГ→ ЕАТФ
3. Хемиосмотическая гипотеза Митчелла. В.П. Скулачевым. Гипотеза опирается на следующие положения: 1. Внутренняя мембрана митохондрий обладает высоким электрическим сопротивлением и очень низкой проницаемостью для протонов и гидроксид-ионов.
2. В ходе дыхания протоны скапливаются в межмембранном пространстве (ММП), т.е. возникает электрохимический потенциал (ЭХП).
3. Протоны могут вернуться в матрикс только через канал АТФ-синтазы. В этот момент происходит разрядка мембраны и синтез АТФ. ЕОК → ЕЭХП → ЕАТФ
Все эти предположения доказаны.
41. Сопряжение окисления с фосфорилированием в дыхательной цепи. Н+-АТФ-синтетаза. Дыхательный контроль. Разобщение дыхания и фосфорилирования. Гипоэнергетические состояния. Сосфвдцасдкрдифгс
Этот комплекс по форме напоминает гриб, ножка которого погружена в мембрану, а круглая шляпка выступает наружу.Состоит из растворимой АТФазы (фактор F1) и мембранных компонентов (комплекс F0). F1 располагается на поверхности внутренней мембраны и обладает каталитической активностью синтеза или гидролиза АТФ. Комплекс F0 состоит из нескольких полипептидных субъединиц, он образует протонный канал в мембране.
Изменение скорости дыхания с изменением концентрации АДФ носит название дыхательного контроля. Скорости дыхания осуществляется отношением АТФ/АДФ. Чем меньше это отношение (преобладание АДФ), тем интенсивнее идет дыхание, обеспечивая выработку АТФ. Для синтеза АТФ в процессе тканевого дыхания необходимо наличие:1) Субстратов окисления. 2) О2.3) Субстратов фосфорилирования, т.е. АДФ и Рн.
Если на синтез АТФ идет меньше энергии, чем обычно, то наступает гипоэнергетическое состояние. Причины:1)Нарушена доставка субстратов окисления (голод). 2) Нарушено поступление О2 (гипоксия). 3) Повреждение внутренней мембраны митохондрий (или действуют разобщители). 4) Различные типы гиповитаминозов – нехватка витаминов РР, В2, В1 и др
Разобщители нарушают дыхательный контроль и стимулируют гидролиз АТФ в митохондриях.
Оказалось, что все разобщители являлись протонофорами – т.е. переносчиками протонов.
Существуют эндогенные разобщители – фенолы, ненасыщенные жирные кислоты и их пероксиды.
Разобщение окисления и фосфорилирования наблюдается при действии экстремальных температур, радиации. У новорожденных находится особый бурый жир, богатый митохондриями. Это имеет значение для защиты ЦНС. В бурой жировой ткани имеются специфические белкитермогенины, которые могут разобщать дыхание и фосфорилирование, участвуя в переносе протонов в матрикс митохондрий. При охлаждении в бурой ткани освобождается норадреналин и выполняет двоякую функцию: активирует термогенины, и гормоночувствительную триглицеринлипазу и стимулирует высвобождение жирных кислот.
42. Окислительные системы, не связанные с аккумуляцией энергии. Микросомальное окисление. Оснссаэмо
а)Пероксидазный путь окисления – это окисление субстрата путем дегидрирования, водород сразу переносится на кислород с образованием перекиси – Н2О2.
SН2 + О2 → S + Н2О2 + Q Интенсивно проходит пероксидазное окисление в лейкоцитах, макрофагах и др. клетках, способных к фагоцитозу. Это связано с тем, что образующаяся Н2О2 используется для обезвреживания бактерий, распада токсичных продуктов. Однако избыточное накопление Н2О2 токсично, т.к. оно ведет к генерации свободных радикалов, повреждающих мембраны клеток. Поэтому простые окислительные системы требуют дополнительных ферментов для обезвреживания Н2О2. Это ферменты пероксидаза, каталаза.
б)Для работы монооксигеназной системы необходимы следующие основные компоненты:
1. Неполярный окисляемый субстрат;
2. Кислород;
3. Дополнительный субстрат (косубстрат) – донор водорода – НАДФН2;
4. Цитохромы Р450.
Цитохром Р450 выполняет двоякую функцию:
1) Связывает субстрат окисления,
2) Проводит активацию молекулярного О2.Микросомальное окисление представляет собой короткую цепь, состоящую из НАДФН2, ФАД, железосерных белков, цитохромов Р450, в5, флавопротеинов, содержащих ФАД.
В общем виде микросомольное окисление неполярных ксенобиотиков (лекарств) осуществляется с помощью гидроксилазного цикла. Вначале первый (основной) субстрат окисления R-CН3 в мембране свя- зывается с цитохромом Р450, железо в котором в форме Fe3+. Чтобы к этому комплексу R-CН3 присоединился О2, нужно Fe2+. Поэтому одновременно с этой реакцией НАДФН2 (косубстрат) окисляется флавопро- теином, протоны и электроны передаются на ФАД и затем с помощью FeS белков происходит разделение потоков протонов и электронов. Первый электрон восстанавливает Fe3+ в Fe2+ в комплексе цитохром Р450-R-CН3. Этот комплекс может уже связать молекулу О2. Второй электрон от FeS активирует молекулу О2 в комплексе и образуется сво- бодный радикал кислорода, он очень активный и происходит введение одного атома О2 в субстрат с образованием гидроксильной группы, а второй атом О2 – соединяется с двумя протонами, образуя Н2О. В результате гидрофобный субстрат приобретает гидрофильные свойства, т.е. возможность выведения из организма с мочой.
в) Диоксигеназы (кислород-трансферазы, истинные оксигеназы). Катализируют включение в молекулу субстрата обоих атомов молекулы О2. Например: гомогентизатоксигеназа катализирует разрыв ароматического кольца гомогентизиновой кислоты. При врожденном дефекте с мочой данного фермента в моче больного накапливается гомогентизиновая ки- слота. Она под действием воздуха окисляется в пигмент черного цвета – алкаптон, который выделяется с мочой и развивается алкаптонурия (моча черного цвета).
43. Окислительные системы, не связанные с аккумуляцией энергии. Активные формы кислорода. Свободно-радикальное окисление. Роль в патологии клеток. Антиокислительные системы организма, характеристика. Оснссаэафксрорвпкасох
А) Активные формы кислорода (АФК)
Термин “АФК” шире, чем “свободные радикалы кислорода” (О2-·, НО·), так как кроме последних включает также молекулы Н2О2 , синглетный кислород 1О2, озон О3 и гипохлорит HOCl.
АФК генерируются во всех частях клетки. Наибольший вклад вносит дыхательная цепь митохондрий, особенно при низкой кон центрации АДФ.
Участвуют ядерная мембрана и другие части клетки, при этом АФК часто возникают не только спонтанно, но и ферментативно (НАДФН-оксидаза дыхательного взрыва в плазматиче- ской мембране и ксантиноксидаза в гиалоплазме). АФК вызывают образование органических гидропероксидов ROOH – ДНК, белков, липидов, а также малых молекул.
Б)Свободно-радикальное окисление..Под свободным радикалом понимают молекулу или ее часть, имеющую неспаренный электрон на молекулярной или на внешней (ва- лентной) атомной орбитале.Молекулярный О2 парамагнитен и обладает двумя не спаренными электронами. Они находятся на разных орбиталях. Восстановление О2 путем прямого введения пары электронов в его частично заполненные орбитали затруднено, т.к. существует «спиновый» запрет. Спиновый запрет – на орбитали могут находиться два электрона с разнона- правленными спинами, т.е. присоединение пары электронов должно сопровождаться «обращением» спина одного из электронов.Образование свободных радикалов:
О2 + ē ® О2-· супероксидный О2-· + Н+ ® НО2· пероксидный О2-· + НО2 + Н+® Н2О2+ О2 О2-· + Н2О2 О2 + ОН- + ОН· Fe3+ Fe2+О2-· + Fe3+ ® О2+ Fe2+
Н2О2+ Fe2+® Fe3++ ОН + ОН· гидроксидный
в) Антиокислительная система организма (АОС) – это система защиты организма от токсического действия кислорода. АОС включает ферментативные и неферментативные компонен- ты. Ферментативные: ферменты супероксиддисмутаза, пероксидаза,каталаза.Супероксиддисмутаза – высокоактивный фермент, присутствующий во всех клетках, она инактивирует супероксидные радикалы.
Пероксидаза – сложный фермент, содержащий геминовое железо. Распространена в основном у растений, а так же в лейкоцитах, тромбо- цитах.Каталаза – гемсодержащий фермент, находится в крови, костном мозге, слизистых оболочках, печени, почках. Неферментативная система защиты1) Витамин Е – содержится в липидной фазе мембраны. Это жирорастворимый витамин. 2) Водорастворимые соединения – аскорбиновая кислота, ураты.3) Биорегуляторы – тироксин, стероидные гормоны.4) Соединения с SН-группой – глутатион, цистеин.
5) Комплексоны – связывающие Fе.
44. Биосинтез и мобилизация гликогена: последовательность реакций, физиологическое значение. Регуляция активности фосфорилазы и синтетазы гликогена. Гликогенозы и агликогенозы. Бимгпрфзрафисггиа
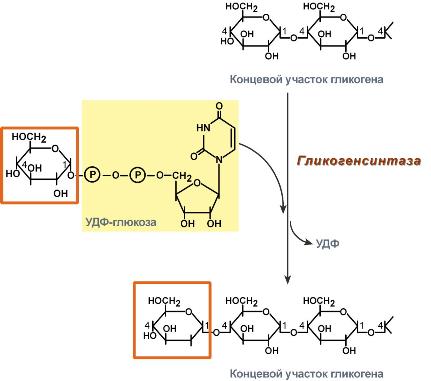
Распад:
1.Гидролитический-при уч. Амилазы, Воды с обр. декстринов и глюкозы.
2.фосфоролитический – под действием Фосфорилазы с исп. H3PO4.Основной
Регуляция:
Адреналин и глюкагон – стимул. Аденилатциклазу,
Повышают содержание ц-3’,5’-АМФ, который
активирует протеинкиназы т.е.стимулир. распад.
Инсунин- понижает активность аденилатциклазы, т.е. стимулирует синтез и тормозит распад.
протеинкиназы- ферменты активируют фосфорилазу, инактивируют – I форму гликогенсинтазы.т.о. синхронизируют регуляцию синтеза и распада.
Гликогеноз – накопление, 9 типов. Агликогеноз – отсутствие.
45. Аэробный распад глюкозы: химизм, физиологическое значение. Челночные механизмы переноса восстановительных эквивалентов.
Распад глюкозы до пирувата можно разделить на два этапа. Первый этап (глюкоза- глицеральдегидфосфат) требует энергии в форме АТФ (2 АТФ).
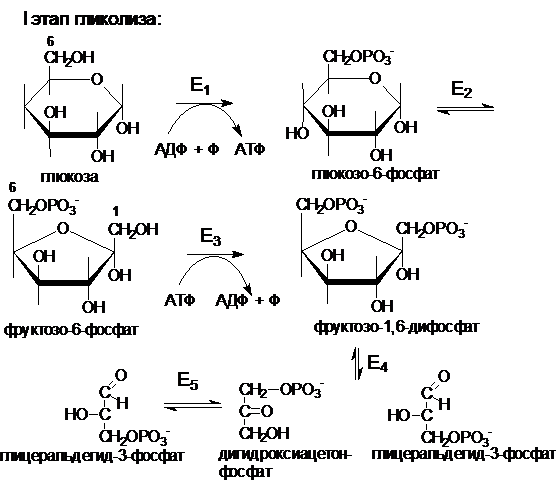
Основное физиологическое значение аэробного распада глюкозы заключается в использовании ее энергии для синтеза АТФ.
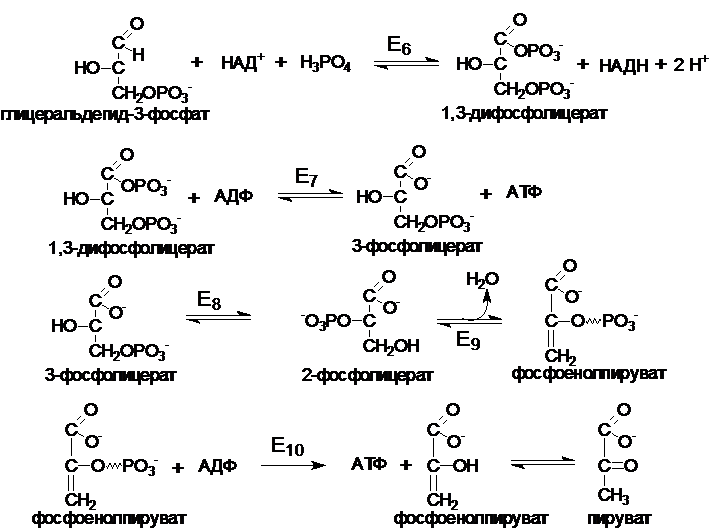
В наибольшей зависимости от аэробного гликолиза находится мозг. Он расходует 100 г глюкозы в сутки. В состоянии основного обмена около 20% кислорода потребляется мозгом. Поэтому недостаток глюкозы или кислорода проявляется, прежде всего, симптомами со стороны центральной нервной системы - головокружением, потерей сознания, судорогами.
Челночные механизмы.
Перенос водорода с цитозольного НАДН в митохондрии происходит при участии специальных механизмов, называющихся челночными. Суть этих механизмов сводится к тому, что НАДН в цитозоле восстанавливает некоторое соединение, способное проникать в митохондрию; в митохондрии это соединение окисляется, восстанавливая внутримитохондриальный НАД+, и вновь переходит в цитозоль. Самая активная малат-аспартатная система, действующая в митохондриях печени, почек и сердца. На каждую пару электронов цитозольной НАДН, переданную на кислород по этой системе, образуется 3 молекулы АТФ.
В скелетных мышцах и мозге перенос восстановительных эквивалентов от цитозольной НАДН осуществляет глицеролфосфатная система. При этом восстановительные эквиваленты передаются в цепь переноса электронов через комплекс II, и поэтому синтезируется только 2 молекулы АТФ.
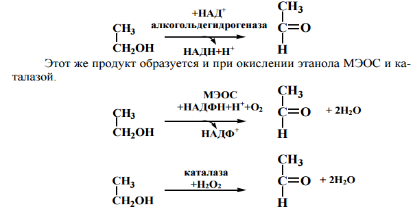
46. Анаэробный распад глюкозы: химизм, физиологическое значение. Центральная окислительно-восстановительная реакция гликолиза. Метаболизм этанола в организме. Аргхфзцовргмэво

Спиртовое брожение
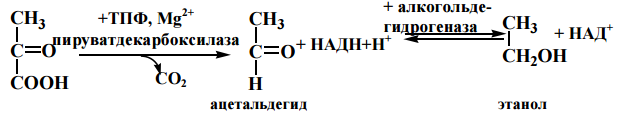
Метаболизм этанола в организме

Этанол, как метаболит – эндогенный(1-9г в сутки,его повышение говорит об
заб. почек, диабете) ,извне – экзогенный. Всасывание: в желудке 20%, а в кишечнике – 80%.
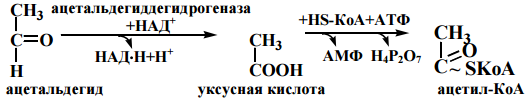
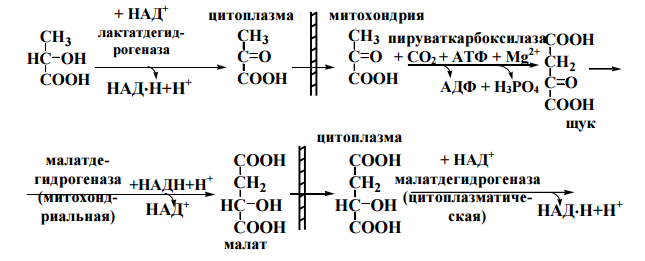
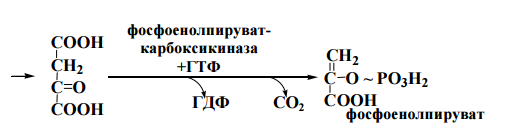
47. Биосинтез глюкозы (глюконеогенез), физиологическое значение. Глюкозо-лактатный цикл (цикл Кори). Бгфзглц
Глюконеогенез-синтез глюкозы из лактата, аминокислот,глицерина. Он протекает в печени и корковом веществе почек. Цель-поддержание уровня глюкозы в крови после истощения запасов гликогена в печени при физич. работе или голодании.

48. Пентозофосфатный путь превращения глюкозы: химизм, биологическая роль. Пппгхбр
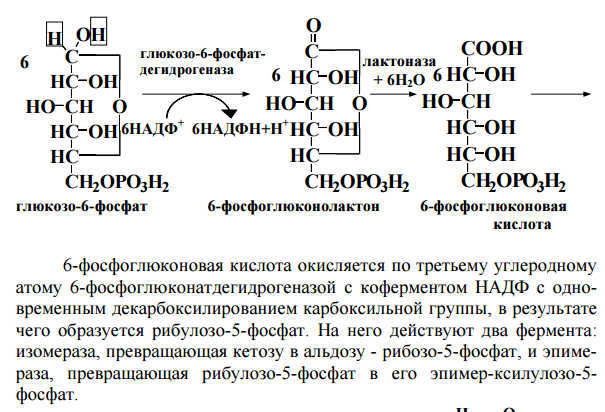
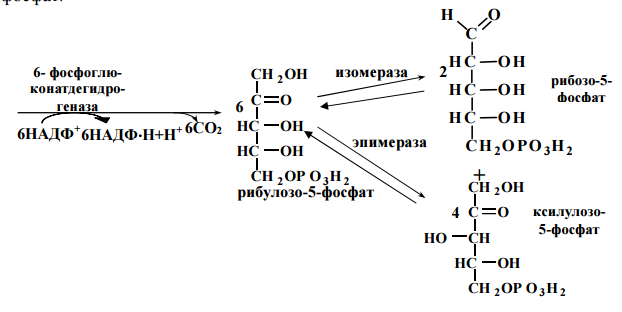
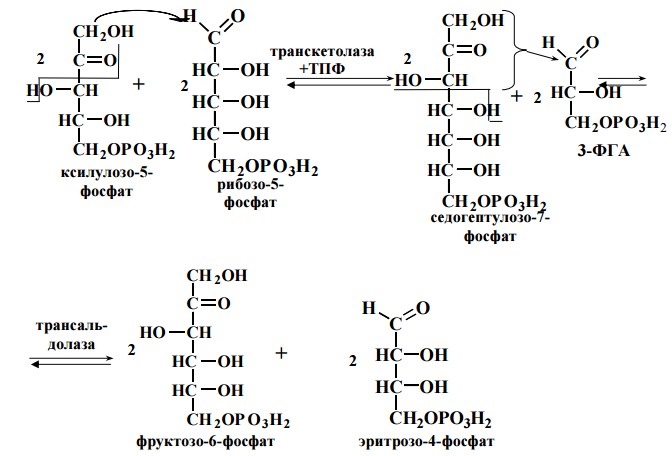

ОБМЕН И ФУНКЦИИ ЛИПИДОВ
49. Пищевые жиры: переваривание, всасывание продуктов расщепления. Роль желчных кислот. Пжпвпрржк
Жиры – это гидрофобные продукты, ферменты их переваривающие – гидрофильны. Поэтому для увеличения поверхности соприкосновения с гидрофильными ферментами жиры должны эмульгироваться (разбиться на капли). Эмульгирование жиров может происходить толь-ко в кишечнике, поэтому основное место переваривания жиров – тонкий кишечник (duodenum). Факторы эмульгирования: 1) перистальтика кишечника, 2) пробулькивание через содержимое кишечника пузырьков СО, образующегося при нейтролизации кислого содержимого желудка бикарбонатами поджелудочного сока, 3) действие поверхностно-активных веществ– желчных кислот, пептонов (продукты переваривания белков) и др. Основную массу жира пищи составляют триацилглицерины. В их переваривании участвует поджелудочная липаза. Она попадает в кишечник в неактивном виде и активируется колипазой и желчными кислотами, оптимум рН ее действия – слабощелочная среда. Продукты переваривания триацилглицеринов: глицерин, жирные кислоты, диацилглицерины, моноацилглицерины. У новорожденных в желудке слабокислая среда,они питаются эмульгированным жиром молока, поэтому у грудных детей возможно переваривание ТГ в желудке под действием желудочной липазы. Гидролиз фосфолипидов происходит в кишечнике под действием фосфолипаз 4-х типов: 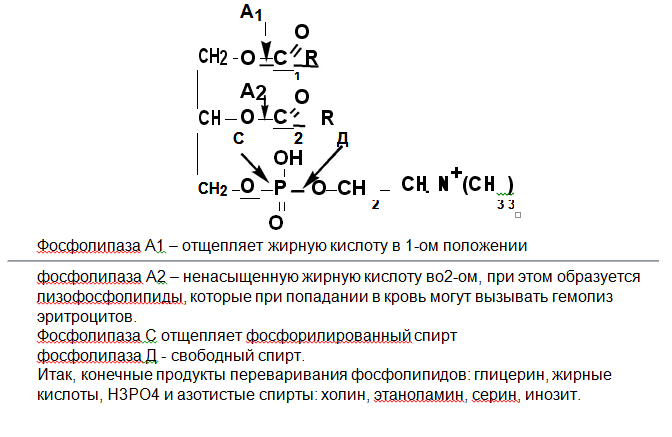
Поступающие с пищей эфиры холестерина расщепляются панкреатической холестеролэстеразой на холестерин и жирную кислоту. В результате переваривания жиров в кишечнике образуется гидрофобные продукты переваривания(холестерин, жирные кислоты с числом С атомов более12, ди- и моноацилглицерины и гидрофильные (глицерин, короткие жирные кислоты, Н3РО4, холин, серин, этаноламин и др.). Всасывание гидрофильных продуктов переваривания в стенку слизистой кишечника происходит самостоятельно, а гидрофобные продукты всасываются в составе мицелл. Большую роль в образовании мицелл играют желчные кислоты. Мицелла – это сферический комплекс, в центре которого находятся транспортируемые гидрофобные продукты переваривания, окруженные желчными кислотами. Придя в слизистую кишечника, мицелла разгружается. Желчные кислоты могут попасть дальше в воротную вену ® в печень ® желчь ® кишечник. Это рециркуляция желчных кислот. Однако основная масса желчных кислот удаляется с содержимым кишечника.
Роль желчных кислот в переваривании жиров:
1) эмульгируют жиры,
2) активируют липазу,
3) создают оптимум рН для действия липазы
4) участвуют во всасывании гидрофобных про-дуктов переваривания, образуя мицеллы.
50. Транспортные липопротеины крови: характеристика, синтез, физиологическая роль. Липопротеинлипаза. Транспорт липидов в организме. Тлкхсфрлтлво
Различают экзогенный, т.е. транспорт пищевых липидов и эндогенный транспорт – т.е. липидов, синтезированных в организме.
Экзогенный транспорт.
Ресинтезированные в энтероцитах триацилглицерины вместе с фосфолипидами, холестерином и белками включаются в хиломикроны. Хиломикроны содержат апопротеин В48 и апоА. Хиломикроны из энте-роцитов попадают в грудной лимфатический проток и далее– в кровь, здесь они встречаются с частицами ЛПВП, содержащими апоЕ и апоС. ХМ отдают апоА частицам ЛПВП, а взамен приобретают апоЕ и апоС. Этот обмен очень важен, т.к. апоСII служит активатором фермента ли-попротеинлипазы – ЛПЛ. Этот фермент синтезируется и секретируется клетками жировой и мышечной ткани, клетками молочных желез. Сек-ретируемый фермент прикрепляется к плазматической мембране эндо-телиальных клеток капилляров тех тканей,где он синтезировался. АпоСII, находящейся на поверхности ХМ, активирует ЛПЛ, она гидро-лизует триацилглицерины в составе ХМ до глицерина и жирных кислот. Освободившиеся жирные кислоты либо поступают в клетки жи-ровой и мышечной ткани, либо соединяются с альбуминами плазмы и транспортируются в общий кровоток. В результате действия ЛПЛ ХМ резко уменьшаются в размерах и называются уже ремнантами (ремнант-остаток). Ремнанты ХМ рецепторным путем захватываются печенью и с ними в печень попадают в основном холестерин и небольшое количест-во триацилглицеринов. Клетки печени включают поступивший холес рин, а также вновь синтезированный, триацилглицерины, фосфолипиды и белки в состав ЛПОНП. Эндогенный транспорт. Основными белками ЛПОНП являются апоВ и апоС, а липидами – триацилглицерины. Кроме того, в печени синтезируется ещё один класс липопротеинов-ЛПВП,у них основной белок – апоА, много фосфолипидов и свободного холестерина, а ядро пустое – так называемые насцентные ЛПВП. Они играют большую роль в обратном транспорте холестерина из клеток периферических тканей в печень. Т.к. ЛПОНП содержат апоСII, происходит активация ЛПЛ, которая гидролизует триацилглицерины ЛПОНП и превращает ЛПОНП в липопротеины промежуточной плотности ЛППП. ЛППП под действием фермента, синтезируемого в печени и секретируемого в кровь,– печеночной триацилглицеринлипазы, превращаются в ЛПНП. Основным липидом в ЛПНП становится холестерин, который в составе ЛПНП переносится к клеткам всех тканей. ЛПНП образуются непосредственно в сосудистом русле и участвуют в прямом транспорте холестерина.
51. Важнейшие липиды тканей человека. Функции липидов. Депонирование и мобилизация жиров в жировой ткани. Регуляция. Транспорт и использование жирных кислот. Влтчфлдимжвжтртиижк
Общая характеристика липидов. Липиды – это обширная группа соединений, различающихся по химической структуре и выполняемым функциям. Признаки липидов: 1) нерастворимость в воде, 2) растворимость в эфире, хлороформе, бензоле, т.е. в полярных органических растворителях3) содержание в своем составе жирных кислот. По своему строению липиды, в большинстве случаев, это сложные эфиры высших жирных кислот с глицерином или некоторыми другими спиртами, также в состав могут входить фосфорная кислота, азотистые основания, углеводы.
Функции липидов:
1. Липиды в виде комплекса с белками являются структурными элементами клеточных мембран. Они определяют текучесть мембраны и транспорт веществ в клетку.
2. 2. Липиды служат энергетическим материалом для организма. При окислении 1 г. жира выделяется 39 кДж энергии, что в 2 раза больше, чем при окислении 1 г углевода.
3. 3.В виде жировой прокладки предохраняют тело и органы животных от механического повреждения (жировая капсула у почек, сальник защищает органы брюшной полости).
4. 4.Липиды сохраняют тепло в организме, обладая хорошими термоизоляционными свойствами (морские животные, пловцы-моржи).
5.Эйкозаноиды обладают регуляторной активностью.
6.Гликолипиды являются важными компонентами нервной ткани, оказывая существенное влияние на функционирование нервной системы.
7.Некоторые липиды являются предшественниками многих биологически активных веществ. Например, из фосфолипидов образуются простагландины, тромбоксан, простациклин, диацилглицерол, инози-толтрифосфат и т.д. Холестерин служит предшественником желчных кислот, стероидных гормонов надпочечников, семенников, яичников и плаценты, из него образуется витамин Д.
8. Эстетическая роль - жировая прокладка смягчает контуры скелета, образуя «округлости», которые создают привычный образ тела человека. С нарушениями обмена липидов связаны такие грозные заболевания как атеросклероз, ожирение, желчно-каменная болезнь и другие.
Жиры – это гидрофобные продукты, ферменты их переваривающие – гидрофильны. Поэтому для увеличения поверхности соприкосновения с гидрофильными ферментами жиры должны эмульгироваться (разбиться на капли). Эмульгирование жиров может происходить только в кишечнике, поэтому основное место переваривания жиров – тонкий кишечник.
Основную массу жира пищи составляют триацилглицерины. В их переваривании участвует поджелудочная липаза. Она попадает в кишечник в неактивном виде и активируется колипазой и желчными кислотами, оптимум рН ее действия – слабощелочная среда. Продукты переваривания триацилглицеринов: глицерин, жирные кислоты, диацилглицерины, моноацилглицерины. Синтез жиров в жировой ткани В жировой ткани для синтеза жиров используются в основном жирные кислоты, освободившиеся при гидролизе жиров ХМ и ЛПОНП. Жирные кислоты поступают в адипоциты, превращаются в производные КоА и взаимодействуют с глицерол-3-фосфатом, образуя сначала лизофосфатидную кислоту, а затем фосфатидную. Фосфатидная кислота после дефосфорилирования превращается в диацилглицерол, который ацилируется с образованием триацилглицерола. Кроме жирных кислот, поступающих в адипоциты из крови, в этих клетках идёт и синтез жирных кислот из продуктов распада глюкозы. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот. Молекулы жиров в адипоцитах объединяются в крупные жировые капли, не содержащие воды, и поэтому являются наиболее компактной формой хранения топливных молекул. Синтез ТАГ в печени. Образование ЛПОНП в печени и транспорт жиров в другие ткани.
Печень - основной орган, где идёт синтез жирных кислот из продуктов гликолиза. В гладком ЭР гепатоцитов жирные кислоты активируются и сразу же используются для синтеза жиров, взаимодействуя с глицерол-3-фосфатом. Как и в жировой ткани, синтез жиров идёт через образование фосфатидной кислоты. Синтезированные в печени жиры упаковываются в ЛПОНП и се-ретируются в кровь. ЛПОНП из печени секретируются в кровь, где на них, как и на ХМ, действует ЛП-липаза. Жирные кислоты поступают в ткани, в частности в адипоциты, и используются для синтеза жиров. В процессе удаления жиров из ЛПОНП под действием ЛП-липазы ЛПОНП сначала превращаются в ЛГШП, а затем в ЛПНП. В ЛПНП основными липидными компонентами служат холестерол и его эфиры, поэтому ЛПНП являются липопротеинами, доставляющими холестерол в периферические ткани. Глицерол, освободившийся из липопротеинов, кровью транспортируется в печень, где опять может использоваться для синтеза жиров. Различают экзогенный, т.е. транспорт пищевых липидов и эндогенный транспорт –т.е. транспорт липидов, синтезированных в организме.
Экзогенный транспорт.
Ресинтезированные в энтероцитах триацилглицерины вместе с фосфолипидами, холестерином и белками включаются в хиломикроны. Хиломикроны содержат апопротеин В48 и апоА. Хиломикроны из энтероцитов попадают в грудной лимфатический проток и далее– в кровь, здесь они встречаются с частицами ЛПВП, содержащими апоЕ и апоС. ХМ отдают апоА частицам ЛПВП, а взамен приобретают апоЕ и апоС. Этот обмен очень важен, т.к. апоСII служит активатором фермента ли-попротеинлипазы – ЛПЛ. Этот фермент синтезируется и секретируется клетками жировой и мышечной ткани, клетками молочных желез. Секретируемый фермент прикрепляется к плазматической мембране эндотелиальных клеток капилляров тех тканей,где он синтезировался. АпоСII, находящейся на поверхности ХМ, активирует ЛПЛ, она гидролизует триацилглицерины в составе ХМ до глицерина и жирных кислот. Освободившиеся жирные кислоты либо поступают в клетки жировой и мышечной ткани, либо соединяются с альбуминами плазмы и транспортируются в общий кровоток. В результате действия ЛПЛ ХМ резко уменьшаются в размерах и называются уже ремнантами (ремнант-остаток). Ремнанты ХМ рецепторным путем захватываются печенью и с ними в печень попадают в основном холестерин и небольшое количество триацилглицеринов. Клетки печени включают поступивший холестерин, а также вновь синтезированный, триацилглицерины, фосфолипиды и белки в состав ЛПОНП. Эндогенный транспорт. Основными белками ЛПОНП являются апоВ и апоС, а липидами – триацилглицерины. Кроме того, в печени синтезируется ещё один класс липопротеинов-ЛПВП,у них основной белок – апоА, много фосфолипидов и свободного холестерина, а ядро пустое – так называемые насцентные ЛПВП. Они играют большую роль в обратном транспорте холестерина из клеток периферических тканей в печень. Т.к. ЛПОНП содержат апоСII, происходит активация ЛПЛ, ко-торая гидролизует триацилглицерины ЛПОНП и превращает ЛПОНП в липопротеины промежуточной плотности ЛППП. ЛППП под действием фермента, синтезируемого в печени и секретируемого в кровь,– пече-ночной триацилглицеринлипазы, превращаются в ЛПНП. Основным липидом в ЛПНП становится холестерин, который в составе ЛПНП пе-реносится к клеткам всех тканей. ЛПНП образуются непосредственно в сосудистом русле и участвуют в прямом транспорте холестерина. Доказано, что синтез ЛПЛ происходит под влиянием инсулина. При сахарном диабете, когда отмечается дефицит инсулина,уровень ЛПЛ снижается. В результате в крови накапливается большое количест-во липопротеинов, богатых триацилглицеринами (IV тип ГЛП).
52. Окисление глицерина: химизм, энергетика, физиологическая роль. огхэфр
53. Активация и окисление высших жирных кислот: химизм, энергетика, физиологическая роль. Аиовжкхэфр
ЖИРЫ КАК ИСТОЧНИК ЭНЕРГИИ. 1. b-окисление жирных кислотНазначение окисления жирных кислот:1 с энергетической целью протекает в печени, почках, скелетной сердечной мышцах; 2) источник эндогенной воды. Окисление жирных кислот происходит в митохондриях. Для удобства процесс окисления можно считать состоящим из 3-х этапов: 1) активация жирных кислот и их транспорт в митохондрии; 2) сам процесс β-окисления; 3) окисления ЦТК образующегося ацетил-КоА. β-окисление жирных кислот означает, что атом C, находящейся в β-положении в процессе окисления становится карбоксильным концом укороченной ацильной цепи.
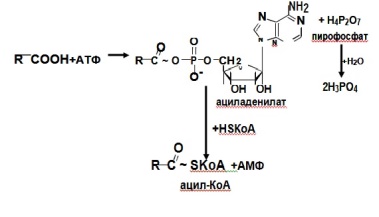
Активация и транспорт жирной кислоты. Происходит в цитозоле.Образуется активная форма жирной кислоты – ацил-КоА. Далее ацил-КоА должен попасть в митохондрии, где непосредственно проходит процесс β-окисления.Мембрана митохондрий не проницаема для ацил-,КоАпоэтому его перенос происходит с помощью карнитина– ацил-карнитин (транспортная форма).
II. b-окисление
В митохондриях происходит перенос остатка жирной кислоты с карнитина на КоА митохондрий с образованием ацил-КоА.Карнитин вновь возвращается в цитозоль. 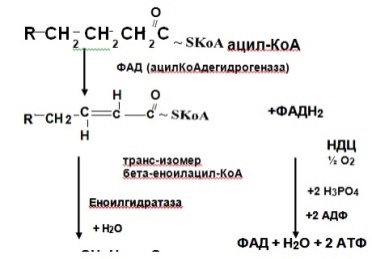
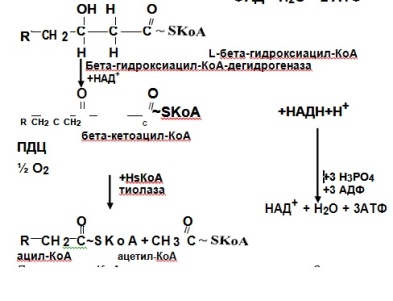
Далее ацил-КоА подвергается вновь процессу β-окисления(т.е. действует ацил-КоАдегидрогеназа), а ацетил-КоА окисляется в ЦТК (общий путь катаболизма). Процесс β-окисления продолжается до обра-зования ацетоацетил-КоА, который распадается до двух молекул аце-тил-КоА.
Катаболизм жирных кислот обеспечивает продукцию энергии. Расчет ведут по формуле:
[5 (n/2-1) + n /2х12] – 1
5 – число молекул АТФ, образуемое при одном акте β-окисления;
n – число атомов C в жирной кислоте; n/2-1 число актов β-окисления; n/2 число молекул ацетил-КоА; 12 – число молекул АТФ при полном окислении одной молекулы ацетил-КоА в ЦТК; 1 – молекула АТФ, за-траченная на активацию жирной кислоты.
Представление об окислении ненасыщенных жирных кислот и жирных кислот с нечетным числом углеродных атомов
Ненасыщенные жирные кислоты до места двойной связи окисляются также, как насыщенные. Если двойная связь не имеет трансконфигурации, то действуют специальные ферменты, обеспечивающие перемещение двойной связи и изменение конфигурации из цис в трансформу. Далее процесс идет обычным путем.
Регуляция окисления жирных кислот
Скорость β-окисления определяется количеством жирных кислот и запасом энергии в клетке. Количество жирных кислот зависит от со-держания жиров в пище и от скорости липолиза эндогенных липидов. β-окисление активируется при накоплении в клетке АДФ и ингибируется накоплением АТФ.
2. Окисление глицерина
Источники глицерина:
Гидролиз триацилглицеринов (ТГ) пищи в кишечнике под действием поджелудочной липазы;
Гидролиз триацилглицеринов, входящих в состав ядра хило-микронов, ЛПОНП под действием липопротеинлипазы в капиллярах жировой, мышечной ткани;
Гидролиз триацилглицеринов ядра ЛППП под действием -пе ченочной триацилглицерин липазы в общем кровотоке;
Гидролиз триацилглицеринов жировой ткани под действием внутриклеточных липаз.
Освободившийся глицерин с током крови разносится ко всем ор-ганам и тканям. В печени, почках, кишечнике, где есть активная глице-ролкиназа, происходит окисление глицерина с образованием 21 АТФ.
Цитозоль Происходит активация глицерина с образованиемa-
глицерофосфата, который поступает в митохондрии с участием- α глицерофосфатного челночного механизма:
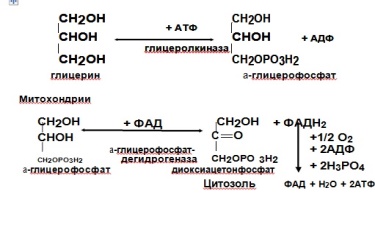
Образующийся в митохондриях диоксиацетонфосфат возвращает-ся в цитозоль, где вступает в реакции специфического пути катаболизма глюкозы.

Дальнейшие превращения 3фосфоглицеринового альдегида могут быть двоякими:
по реакциям глюконеогенеза до глюкозо-6-фосфата и далее с образованием свободной глюкозы;
по реакциям гликолиза до пирувата, который затем окисляется
в общей стадии катаболизма до СО2 и Н2О.
Энергетический эффект окисления глицерина до СО2 и Н2О (21 АТФ)
54. Биосинтез и использование кетоновых тел. Биикт
Ацетил-КоА включается в ЦТК в условиях,когда расщепление жиров и углеводов сбалансировано.Ускоренный катаболизм жирных кислот или сниженный уровень использования углеводов(как порознь, так и в сочетании) могут приводить к накоплению ацетил-КоА и синтезу из него кетоновых тел: ацетоацетата, b-гидроксибутирата и ацетона. Синтез кетоновых тел происходит в митохондриях печени.Ацето-ацетат образуется из ацетил-КоА в3 стадии. Вначале 2 молекулы аце-тил-КоА конденсируются с образованием ацетоацетил-КоА:
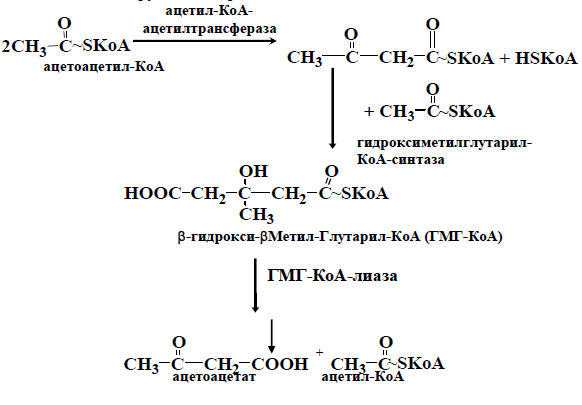
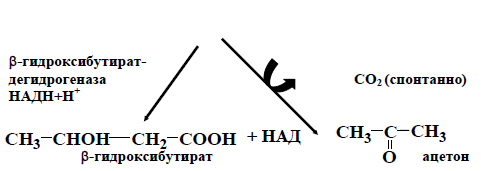
В норме в митохондриях печени образуется небольшое количество кетоновых тел. В печени ацетоацетат не может окислиться,по-этому с током крови он попадает в скелетные мышцы, сердце, мозг, ко-торые способны превращать ацетоуксусную кислоту вновь в ацетил-КоА.
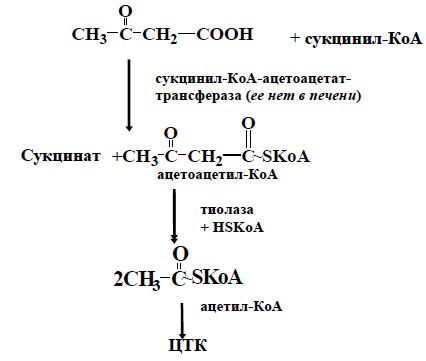
Таким образом, ацетоацетат в норме выполняет роль источ-ника энергии для сердечной мышцы, скелетных мышц, мозга.
Голодание и диабет, ведущие к усиленному освобождению жир-ных кислот из тканевых депо и к снижению метаболизма углеводов в печени, приводят к образованию такого избытка кетоновых тел, что внепеченочные ткани не справляются с их утилизацией. Это приводит к накоплению кетоновых тел в крови(кетонемия), которые обладают свойствами кислот, что снижает рН и развивается метаболический аци-доз. При большом избытке кетоновых тел они выводятся почками,т.е. возникает кетонурия. В крайне тяжелых случаях ацетон выводится через легкие и может быть обнаружен в выдыхаемом воздухе.
55. Биосинтез жирных кислот: синтез и роль малонил-КоА, характеристика пальмитатсинтетазного комплекса, регуляция. Пути образования жирных кислот с более длинной углеродной цепью и ненасыщенных жирных кислот. Бжксирмкхпкрпожксбдуцинжк
Биосинтез жирных кислот можно рассматривать как процесс, складывающийся из 3 этапов. I. Транспорт ацетил-КоА в цитозоль из митохондрий II. Образование малонилКоА III. Конденсация этих молекул и их восстановление с образовани-ем высших насыщенных жирных кислот, главным образом пальмитиновой.
I этап. Образование ацетил-КоА происходит в митохондриях, а их мембрана непроницаема для ацетил-КоА.Перенос ацетильных групп происходит при помощи цитрата (цитратный челночный механизм).

ЩУК может вернуться в митохондрии с помощью своей трансло-казы, но чаще она восстанавливается до малата с участием малатдегид-рогеназы (МДГ).
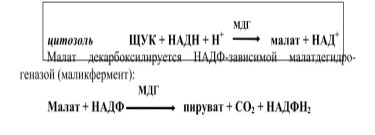
Образующийся НАДФН2 используется в дальнейшем для синтеза жирных кислот.
II этап. Ацетил-КоА карбоксилируется под действием ацетил-КоА-карбоксилазы, сложного фермента, коферментом которого служит витамин биотин. 
Эта реакция лимитирует скорость всего процесса синтеза жирных кислот.
III этап протекает при участии мультиферментного пальмитат-
синтазного комплекса. Он состоит из двух полипептидных цепей. Ка-ждая полипептидная цепь содержит все 6 ферментов синтеза (трансаци-лаза, кетоацилсинтаза, кетоацилредуктаза, гидратаза, еноилредуктаза, тиоэстераза). Ферменты связаны между собой ковалентными связями, ацилпереносящий белок (АПБ) является также частью полипептидной цепи, но его функция связана только с переносом ацильных радикалов. В процессе синтеза важную роль играюттиогруппы. Одна из них при-надлежит 4-фосфопантотеину, входящему в состав АПБ (центральная) и вторая – цистеину кетоацилсинтазы (периферическая). Функциональ-ная единица синтеза состоит из половины одного мономера, взаимодей-ствующего с комплементарной половиной второго мономера,где цен-
тральная SH-группа одного мономера очень близка к периферической SH-группе другого. Т.е. на синтазном комплексе синтезируются одно-временно 2 жирные кислоты и только димер активен. Перенос субстрата от фермента к ферменту происходит при участии АПБ
Реакции 3 этапа
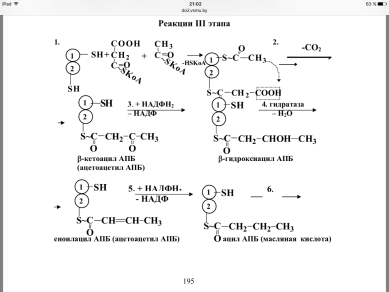

56. Типы гиперлипопротеинемий. Биохимия атеросклероза. Тгба
Гиперлипопротеинемия (гиперлипидемия, дислипидемия) – повышенное содержание жиров (липидов) в крови. При гиперлипопротеинемии может увеличиваться и концентрация липопротеинов – сложных соединений белка и жиров. Гиперлипопротеинемия встречается весьма часто, она может протекать без всяких симптомов и определяться только на основании лабораторных исследований. Это состояние связывают, в первую очередь, с развитием атеросклероза, который является причиной многих сердечно-сосудистых заболеваний и гипертонии. Изредка гиперлипопротеинемия способствует развитию панкреатита (воспаления поджелудочной железы), судорожных болей в животе, нейропатии, блуждающего артрита.
Существует первичная гиперлипопротеинемия, возникающая как результат генетической предрасположенность, и вторичная гиперлипопротеинемия – один из симптомов различных заболеваний, связанных с нарушением обмена веществ. От типа гиперлипопротеинемии зависит и выбор лечения:








