2. В-ва, связывающие SH группы акт. Ц. – моно- иодацетат, соединения ртути и мышьяка.
3. В-ва, связывающие OH-группы серина в акт. Ц. – фосфорорганические соединения.
Обратимые бывают конкур. и неконкур.
Конкурентные-ингибиторы, кот. По своему строению очень похожи на субстрат, всегда будут присоед. к акт ц.
Действие конкур. ингиб.
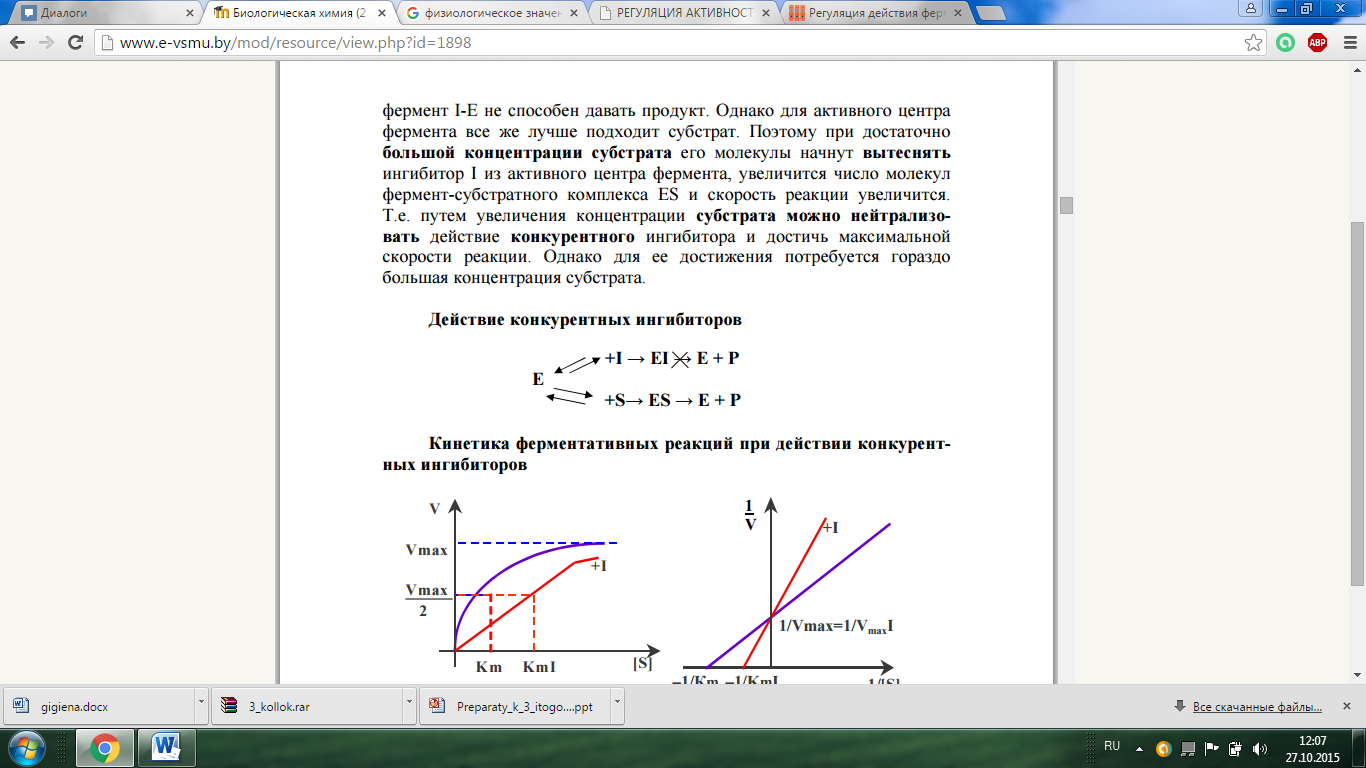
конкурентные ингибиторы увеличивают Km реакции, но не влияют на Vmax
Примеры:

СДГ-субцинатдегидрогеназа
Неконкурентные-никогда не взаимод. С акт. Ц. ингибитора
E + S + I → ESIмедленно -----→ E + P + I
неконкурентные ингибиторы понижают Vmax, но не влияют на Km.
Активаторы ферментов – вещества, которые разными путями повышают способность ферментов ускорять реакцию.
Свойства активаторов:
1. Формируют акт. Ц. фермента (Со2+ Mg2+, Zn2+, Fe2+ , Cu2+).
2. Облегчают образование фермент-субстр. комплекса (Mg2+, Мn 2+).
3. Стабилизируют нативную структуру фермента.
4. Защищают функциональные группы активного центра от повреждения(восстанавливают SH-группы активного центра (глутатион, цистеин))
5. Воздействуют на субъединицы молекулы фермента (протеинкиназа регулируется цАМФ).
Обычно активаторы- катионы,реже анионы, могут быть белки: апопротеины АI активирует ЛХАТ, апопротеины СII ® ЛПЛ.
Для лечения подагры ведущее место занимает использование аллопуринола-конкурентного ингибитора ксантиноксидазы.
Антиметаболиты- это конкурентные ингибиторы природных субстратов. Пример: сульфаниламидные препараты
ПАБК-парааминобензойная к-та SA-сульфаниламиды
Мед. Энзимология-включает энзимодиагн., -терап., -патол.
Энзимодиагностика – исследование ферментов в биологических средах организма с диагностической целью.
Изоферменты – это молекулярные формы фермента, которые ка- тализируют одну и ту же реакцию, но различаются по некоторым свой- ствам: аминокислотной последовательности, молекулярной массе, ами- нокислотному составу, субстратной специфичности, элетрофоретиче- ской подвижности.
Энзимотерапия – это использование ферментов и регуляторов их активности в качестве лекарственных средств.
Наследственные энзимопатии – заболевания, связанные с на- следственными дефектами ферментов. Изменения при этом могут быть двух типов: 1) Связанные с образованием избытка субстрата реакции или его предшественников. Например, накопление и выделение галактозы при дефекте фермента, превращающего галактозу в фруктозу – галактоземия. 2) Связанные с недостаточностью образования продуктов изменен- ной химической реакции
10. Регуляция действия ферментов: аллостерические механизмы, кооперативные эффекты, химическая модификация, по принципу обратной связи, понятие о проферментах, мультиферментных комплексах. Примеры метаболических путей, регулируемых этими механизмами. Физиологическое значение регуляции действия ферментов.
Регуляция каталитической эффективности ферментов - это все изменения активности фермента, происходящие при постоянном его количестве.
1. Превращение проферментов в активные ферменты. Ряд ферментов синтезируются в неактивной форме – в виде проферментов. Чтобы перейти в активную форму, профермент должен подвергнуться ограниченному протеолизу. В ходе протеолиза открывается или формируется активный центр и фермент активируется. (Протеолитические ферменты синтезируются в поджелудочной железе в форме проферментов, а активация происходит только в желудочно-кишечном тракте при появлении пищи)
2. Химическая модификация. Это ковалентное присоединение или отщепление от фермента небольшой химической группы, что приводит к изменению активности фермента. Чаще всего к ферменту присоединяется или отщепляется фосфатная группа – фосфорилирование- дефосфорилирование фермента (синтез и распад гликогена)
3.Мультиферментные комплексы. Это объединение нескольких ферментов, катализирующих многоступенчатую последовательность метаболических реакций (все ферменты синтеза жирных кислот объединены в единый мультиферментный комплекс – синтаза.)
4.Аллостерическая регуляция. Это регуляция путем взаимодействия эффекторов с аллостерическим центром фермента. характерна для ферментов, имеющих субьединичное строение. Их называют аллостерическими или регуляторными ферментами. Каждая субъединица такого фермента содержит свои активный и аллостерический центры.
В аллостерических ферментах активный центр одной субъединицы фермента оказывает влияние на активный центр другой субъединицы в той же молекуле. В результате такого взаимодействия между субъединицами связывание субстрата становится кооперативным. Для объяснения кооперативных эффектов используют 2 модели: симметричную (Моно, Уаймен, Шанжи) и последовательную. По симметричной модели каждый мультимерный фермент может существовать в двух разных состояниях с неодинаковой четвертичной структурой, но все субъединицы в этих состояниях имеют одинаковую третичную структуру. S+TT →RR
Последовательная модель, кроме состояний ТТ, RR допускает существование состояния TR, когда отдельные субъединицы мультимера могут в одно и то же время иметь разные третичные структуры. S+TT → TR →RR (+)
5. Регуляция по типу обратной связи. Характерна для последовательных реакций, при этом каждая реакция катализируется своим ферментом. Различают ретроингибирование и форактивацию: а) Ретроингибирование – ингибирование по типу отрицательной обратной связи. Конечный продукт Z обычно не влияет на активность промежуточных ферментов системы, а ингибирует ее первый фермент Е1.
б) Форактивация – активация предшественником. Накопление субстрата А стимулирует его распад до продукта Z через активацию фермента более поздних стадий превращения.
Наиболее важным свойством ферментов в обеспечении процессов жизнедеятельности является способность осуществлять присущие им функции со скоростью, соответствующей потребностям клетки. Поэтому для осуществления этой способности белковые молекулы должны иметь специальные механизмы, с помощью которых они воспринимают сигналы из окружающей среды и реагируют на них изменением характера функционирования.
НУКЛЕИНОВЫЕ КИСЛОТЫ. БИОСИНТЕЗ БЕЛКОВ
11. Представление о биосинтезе и распаде пуриновых и пиримидиновых нуклеотидов. Нарушения обмена нуклеотидов (подагра, ксантинурия, оротацидурия).
Все живые организмы способны синтезировать пуриновые и пиримидиновые нуклеотиды из простых соединений; глицина, аспартата, глутамина, рибозы, СО, и NHr При этом в клетках функционируют два разных метаболических процесса. В процессе синтеза пуринов реализуются действия 11 ферментативных реакций, которые протекают при участии коферментов и энергетических молекул. Данные исследования были выполнены в лабораториях Дж. Бьюкенена, Дж. Гринберга и А. Корнберга.Установлено, что конечным результатом синтеза пуринов является ри- бонуклеотид инозиновая кислота (ИМФ), из которой впоследствии синтезируются АМФ и ГМФ. Синтез инозиновой кислоты начинается с реакции фосфорилирования D-рибозо-5-фосфата, который образуется в пентозофосфатном цикле. Реакция протекает при участии пирофосфо- рилазы и АТФ. Образовавшийся 5-фосфорибозил-1 -пирофосфат взаимодействует с глутамином, в результате чего образуется p-5-фосфорибозил- амин. Причем в процессе реакции наряду с освобождением пирофосфата и свободной глутаминовой кислоты происходит изменение конфигурации p-5-фосфорибозил-амина из a-формы в p-форму. Данная реакция является лимитирующей в синтезе пуринов.
На следующей стадии происходит присоединение молекулы глицина к свободной NH,-группе p-5-фосфорибозил-амина с образованием гли- цинамидрибонуклеотида. Для протекания реакции требуется АТФ. Затем, на следующей стадии, происходит удлинение радикала за счет присоединения формильной группы из М5,М|0-метенил-ТГФК с образованием формилглицинамидрибонуклеотида. На формильную группу последнего переносится амидная группа глутамина и синтезируется формилглицин- амидинрибонуклеотид. Реакция протекает также в присутствии АТФ. Далее замыкается пятичленное имидазольное кольцо и образуется 5-ами- ноимидазолрибонуклеотид, который способен акцептировать СО, с образованием рибонуклеотида 5-аминоимидазол-4-карбоновой кислоты.
В последующем двухступенчатом процессе, в котором участвуют аспарагиновая кислота и АТФ, образуется 5-аминоимидазол-4-карбоксамид- рибонуклеотид и освобождается фумаровая кислота. В этих реакциях азот аспарагиновой кислоты включается в 1-е положение будущего пуринового ядра. Последний углеродный атом пиримидинового остатка кольца пурина вводится в виде формильного остатка, который присоединяется к 5-NH,-группе. После этого отщепляется молекула воды и второе кольцо замыкается. В результате образуется первый пуриновый нуклеотид — ино- зиновая кислота (ИМФ), которая является предшественником пуриновых нуклеотидов в составе нуклеиновых кислот.
АМФ и ГМФ образуются из ИМФ, причем в синтезе обоих мононуклеотидов участвуют по два фермента, отличающихся по механизму действия. Образование ГМФ из ИМФ катализируют ИМФ-дегидрогеназа и ГМФ- синтетаза, а образование АМФ из того же предшественника катализируется последовательным действием аденилосукцинатсинтетазы и аденилосукци- натлиазы. Механизм двухэтапного синтеза АМФ и ГМФ можно представить в виде нескольких ферментативных реакций (рис. 14.2).
В ферментативном синтезе АМФ из ИМФ участие принимают аспарагиновая кислота, являющаяся донором NH ,-группы, и ГТФ в качестве источника энергии. Промежуточным продуктом реакции является адени- лоянтарная кислота. Биосинтез ГМФ, напротив, начинается с дегидроге- назной реакции ИМФ с образованием ксантозиловой кислоты; в амини- ровании последней используется только амидный азот глутамина.
Превращение АМФ и ГМФ в соответствующие нуклеозидди- и нук- леозидтрифосфаты также протекает в 2 стадии при участии киназ (нук- леозидмонофосфаткиназа и нуклеозиддифосфаткиназа). В клетках синтез пуриновых нуклеотидов регулируется конечными продуктами ферментативных реакций по принципу обратной связи. Регуляторное действие оказывается на фермент, катализирующий первую стадию процесса — перенос аминогруппы глутамина на 5-фосфорибозил-1-пирофосфат. При этом проявляется аллостерический механизм регуляции. Кроме того, избыток ГМФ в клетках оказывает аллостерическое торможение только на свой собственный синтез, не влияя на синтез АМФ, и, наоборот, накопление АМФ подавляет свой синтез, не ингибируя синтеза ГМФ.
Синтез пиримидинов начинается с ферментативных реакций, в которых субстратами являются СО,, NH3 и аспартат. Процесс инициируется карбамоилфосфатсинтетазой. катализирующей образование карбамоилфосфата из глутамина. Далее карбамоилфосфат реагирует с ас- партатом с образованием N-карбамоиласпарагиновой кислоты. Последняя подвергается циклизации с отщеплением молекулы воды, при этом образуется дигидрооротовая кислота, которая в дальнейшем подвергается дегидрированию, превращаясь в оротовую. Последняя обратимо реагирует с 5-фосфорибозил-1-пирофосфатом с образованием оротидин-5'-фосфата, декарбоксилирование которого приводит к образованию пиримидинового нуклеотида — уридин-5-фосфата.
Образовавшаяся ЦТФ может ингибировать активность аспартаткар- бамоилтрансферазы, проявляя аллостерический тип ингибирования, реализуя механизм ингибирования по типу обратной связи.
Таким образом осуществляется контроль за активностью фермента лимитирующей стадии процесса синтеза пиримидиновых нуклеотидов.
Распад пиримидиновых нуклеотидов, как и в случае распада пуриновых нуклеотидов, начинается с превращения нуклеотидов в нуклеозиды, т. е. происходит образование нуклеози- дов — цитидина, уридина, тимидина. Превращение пиримидиновых нуклеотидов в нуклеозиды катализируется различными фосфатазами.
На первом этапе цитидин дезаминируется с образованием уридина. Следующим этапом является передача углеводного компонента нуклеозида уридина на фосфорную кислоту с получением свободного урацила и рибозо-1-фосфата. Урацил при участии дегидрогеназы (НАДФН + Н+) восстанавливается в дигидроурацил. Дигидроурацил под влиянием гидразы с разрывом пиримидинового кольца трансформируется в (З-уреидопропироновую кислоту:
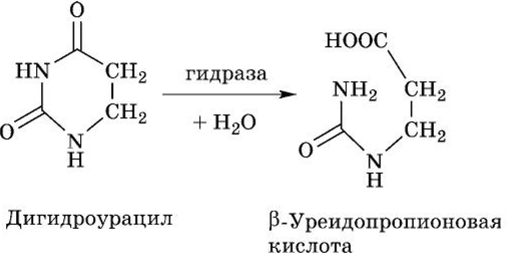
(З-Уреидопропионовая кислота с участием уреидопропиона- зы распадается с образованием NH3, С02 и р-аланина:
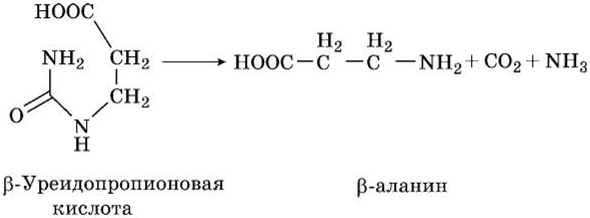
р-аланин играет важную физиологическую роль в тканях, поскольку является составной частью структуры коэнзима А. р-аланин может быть использован и для синтеза ансерина и кар- нозина — имидазолсодержащих дипептидов мышечной ткани, участвующих в мышечном сокращении, С02 и NH3 включаются в биосинтез мочевины.
Схема распада тимина: 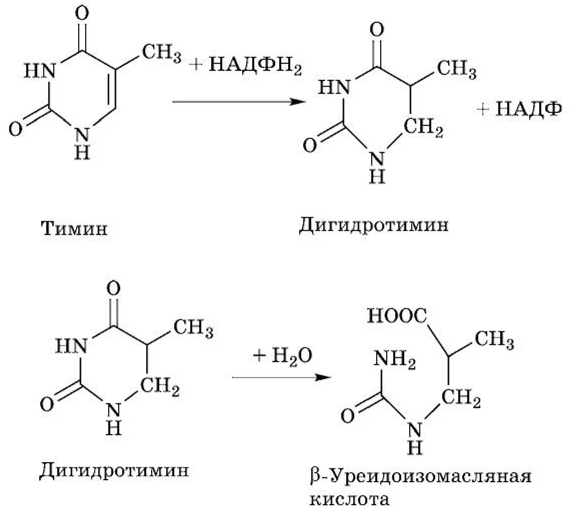
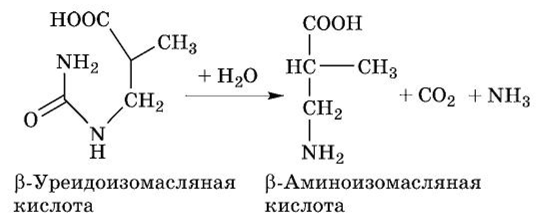
(З-Аминоизомасляная кислота экскретируется с мочой из организма. Повышение концентрации этой кислоты в моче наблюдается после приема кормов, богатых ДНК, или у «раковых» больных после химиотерапии или физиотерапии, при которых разрушается большое число клеток. Часть (3-амино- изомасляной кислоты через ряд реакций трансформируется в сукцинил-КоА (компонент цикла трикарбоновых кислот).
Вначале нуклеиновые кислоты при участии соответствующих ферментов (ДНК- и РНК-азы) деполимеризуются с образованием пуриновых и пиримидиновых нуклеотидов. Нуклеотиды под действием нуклеотидаз гидролитически распадаются до нуклеозидов. Процесс распада пуриновых мононуклеозидов (аденозина и гуанозина) активно протекает в печени, почках, слизистой кишечника животного. Рассмотрим распад АМФ.
АМФ переходит в аденозин — нуклеозид, включающий аде- нин и рибозу. Аденозин претерпевает гидролитическое дезаминирование при участии адениндезаминазы, образуя инозин:
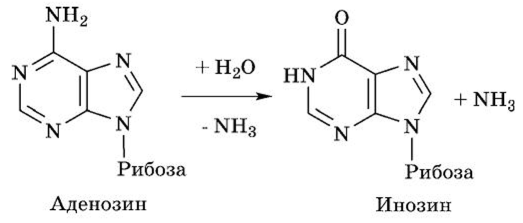
Инозин передает рибозу на фосфорную кислоту с образованием рибозофосфата и гипоксантина: 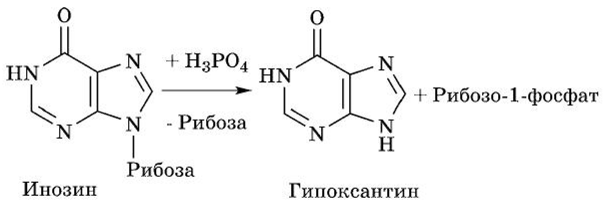
Гипоксантин при участии Мо- и Fe-содержащего фермента ксантиноксидазы с простетической группой ФАД окисляется в ксантин:
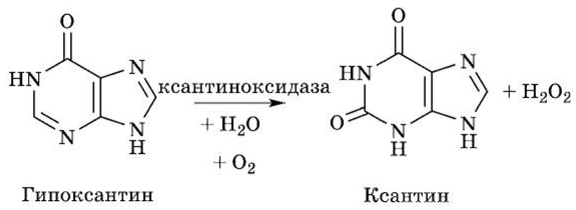
Данная реакция — пример сокращенного пути биологического окисления, когда атомы водорода от субстрата с участием ксантиноксидазы передаются прямо на молекулярный кислород, образуя перекись водорода, но не молекулу воды, как в случае при классическом биологическом окислении.
Под влиянием этого же фермента (ксантиноксидазы) ксантин окисляется в мочевую кислоту:
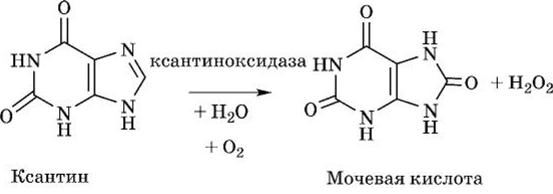
Ксантиноксидаза играет важнейшую роль, особенно в почках и печени птиц, которые экскретируют мочевую кислоту как основной конечный азотсодержащий продукт метаболизма пуринов. Ксантиноксидаза в больших количествах присутствует в печени, слизистой кишечника и в молоке. Мочевая кислота у человека, птиц является также основным продуктом азотистого обмена, соответствуя мочевине у других видов животных.
У птиц избыток аминного азота идет на синтез пуринов, которые расщепляются затем до мочевой кислоты, очень плохо растворимой в воде. Такой обходной путь выведения азота сохраняет гомеостаз воды в организме птицы. Кислая моча птиц представляет собой суспензию кристаллов мочевой кислоты, которые экскретируются из организма с минимальным количеством воды. Мочевая кислота составляет основу сухого вещества мочи птиц (70-80%). Поэтому в промышленных целях мочевую кислоту получают из экскрементов морских птиц.
У млекопитающих (крупный и мелкий рогатый скот, свиньи, лошади, собаки) при участии фермента уриказы мочевая кислота превращается в аллантоин, конечный продукт распада пуриновых оснований:
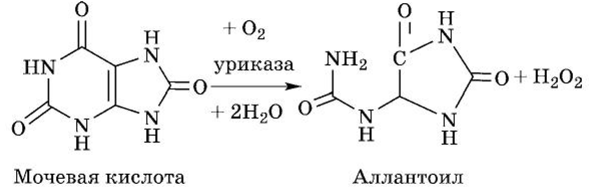
У рыб фермент аллантоиназа осуществляет разрыв имидазольного цикла аллантоина, что приводит к получению аллан- тоиновой кислоты:
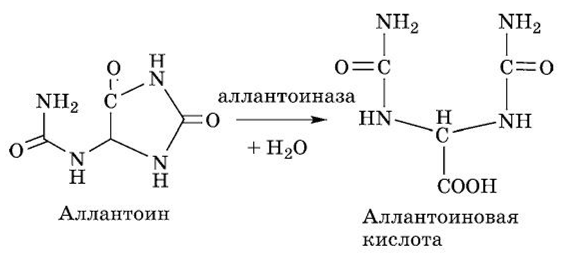
У хрящевых рыб (акулы и скаты) и амфибий аллантоиновая кислота далее распадается при участии фермента аллантоиназы и воды на две молекулы мочевины и глиоксиловую кислоту:
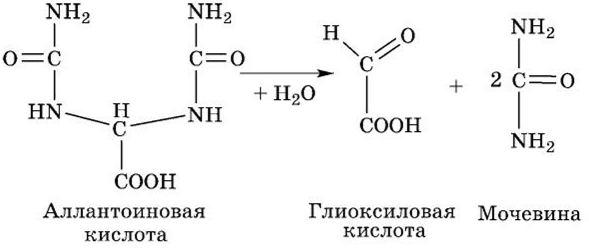
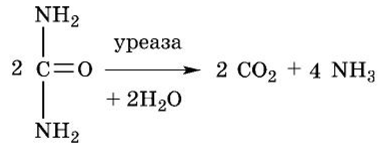
Большинство морских беспозвоночных (и ракообразных) с участием фермента уреазы разлагают мочевину на воду и С02:
Другой пурин — гуанин — по аналогичной схеме под действием фермента гуаназы превращается в ксантин и далее в точности повторяется катаболический путь ксантина.
Одним из характерных нарушений нуклеинового обмена является подагра (поражения суставов и почек) — болезнь, сопровождающаяся резким повышением концентрации мочевой кислоты в сыворотке крови. Воспаление суставов связано с осаждением в них кристаллов натриевой соли мочевой кислоты. Вероятно, подагра — результат различных врожденных нарушений метаболизма с избыточным синтезом уратов. Такое состояние возможно при нарушении механизмов выведения кислоты через почки и при условии ее усиленного синтеза. Подагра характеризуется отложением в суставах, слизистых сумках, почках, коже, мышцах узелков кристаллов мочевой кислоты и ее натриевой соли.
Икра рыб (богата нуклеиновыми кислотами) в рационе человека может обострять болезнь. Для снижения синтеза мочевой кислоты в организме используют аллопуринол — аналог гипоксантина, который является ингибитором ксантиноксида-
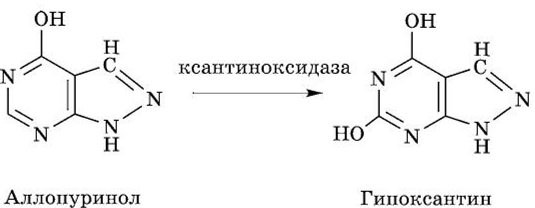
зы. Гипоксантин и ксантин не аккумулируются в больших концентрациях, так как они более растворимы и легко экскрети- руются из организма.
12. Нуклеопротеиды. ДНК, уровни структурной организации, способы укладки в хроматине и хромосомах. Повреждения ДНК. Репарация ДНК.
Дезоксирибонуклеи́новая кислота (ДНК) — макромолекула (одна из трёх основных, две другие — РНК и белки), обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК содержит информацию о структуре различных видов РНК и белков.
В клетках эукариот (животных, растений и грибов) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами.
С химической точки зрения ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков — нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы (С) и фосфатной (Ф) группы (фосфодиэфирные связи).
В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула закручена по винтовой линии.
В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин). Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином (А-Т), гуанин — только с цитозином (Г-Ц). Именно эти пары и составляют «перекладины» винтовой "лестницы" ДНК
Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции, и принимают участие в биосинтезе белков (процессе трансляции). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции.
Расположение базовых комбинаций химических соединений ДНК и количественные соотношения между этими комбинациями обеспечивают кодирование наследственной информации.
Образование новой ДНК (репликация)
1. Процесс репликации: раскручивание двойной спирали ДНК — синтез комплементарных цепей ДНК-полимеразой — образование двух молекул ДНК из одной.
2. Двойная спираль «расстегивается» на две ветви, когда ферменты разрушают связь между базовыми парами химических соединений.
3. Каждая ветвь является элементом новой ДНК. Новые базовые пары соединяются в той же последовательности, что и в родительской ветви.
По завершении дупликации образуются две самостоятельные спирали, созданные из химических соединений родительской ДНК и имеющие с ней одинаковый генетический код. Таким путем ДНК способна перерывать информацию от клетки к клетке.
Дезоксирибонуклеиновая кислота (ДНК) относится к нуклеиновым кислотам. Нуклеиновые кислоты – это класс нерегулярных биополимеров, мономерами которых являются нуклеотиды.
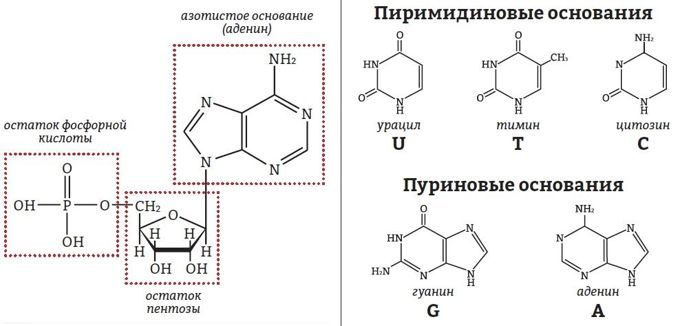
НУКЛЕОТИДЫ состоят из азотистого основания, соединенного с пятиуглеродным углеводом (пентозой) – дезоксирибозой (в случае ДНК) или рибозой (в случае РНК), который соединяется с остатком фосфорной кислоты (H2PO3–).
Азотистые основания бывают двух типов: пиримидиновые основания – урацил (только в РНК), цитозин и тимин, пуриновые основания – аденин и гуанин.
Атомы углерода в молекуле пентозы нумеруются числами от 1 до 5. Фосфат соединяется с третьим и пятым атомами углерода. Так нуклеинотиды соединяются в цепь нуклеиновой кислоты. Таким образом, мы можем выделить 3’ и 5’-концы цепи ДНК:
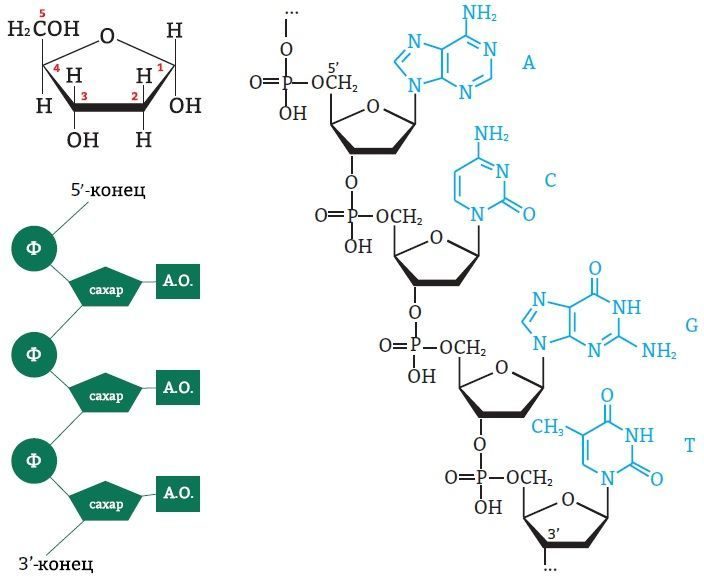
Рис. 6. Выделение 3’ и 5’-концов цепи ДНК
Две цепи ДНК образуют двойную спираль. Эти цепи в спирали сориентированы в противоположных направлениях. В разных цепях ДНК азотистые основания соединены между собой с помощью водородных связей. Аденин всегда соединяется с тимином, а цитозин – с гуанином. Это называется правилом комплементарности (см. принцип комплементарности).
Правило комплементарности:
| A–T G–C |
Например, если нам дана цепь ДНК, имеющая последовательность
3’– ATGTCCTAGCTGCTCG – 5’,
то вторая ей цепь будет комплементарна и направлена в противоположном направлении – от 5’-конца к 3’-концу:
5’– TACAGGATCGACGAGC– 3’.
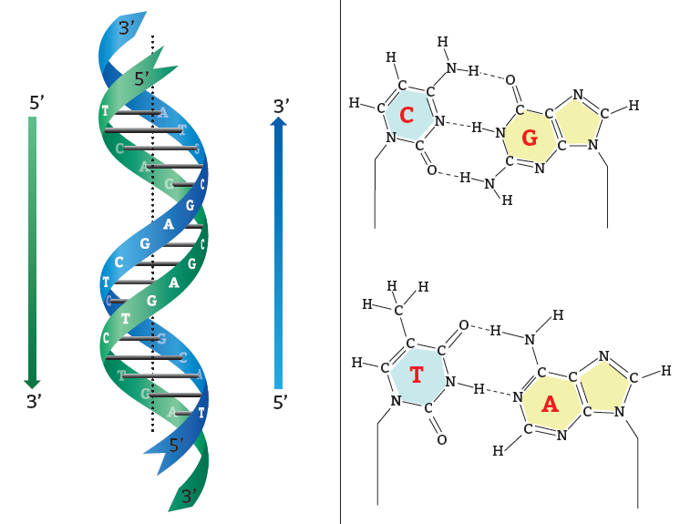
Рис. 7. Направленность цепей молекулы ДНК и соединение азотистых оснований с помощью водородных связей
РЕПЛИКАЦИЯ ДНК
Репликация ДНК – это процесс удвоения молекулы ДНК путем матричного синтеза. В большинстве случаев естественной репликации ДНК праймером для синтеза ДНК является короткий фрагмент РНК (создаваемый заново). Такой рибонуклеотидный праймер создается ферментом праймазой (ДНК-праймаза у прокариот, ДНК-полимераза у эукариот), и впоследствии заменяется дезоксирибонуклеотидами полимеразой, выполняющей в норме функции репарации (исправления химических повреждений и разрывов в молекле ДНК).
Репликация происходит по полуконсервативному механизму. Это значит, что двойная спираль ДНК расплетается и на каждой из ее цепей по принципу комплементарности достраивается новая цепь. Дочерняя молекула ДНК, таким образом, содержит в себе одну цепь от материнской молекулы и одну вновь синтезированную. Репликация происходит в направлении от 3’ к 5’ концу материнской цепи.
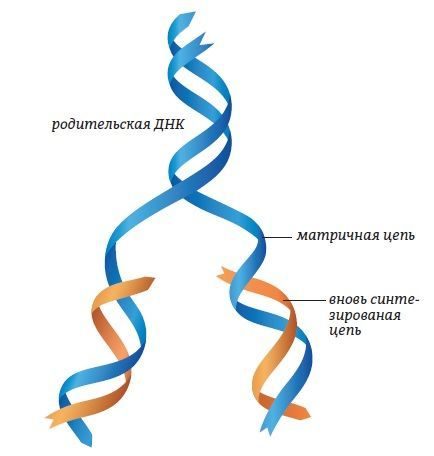
Рис. 8. Репликация (удвоение) молекулы ДНК
ДНК-синтез – это не такой сложный процесс, как может показаться на первый взгляд. Если подумать, то для начала нужно разобраться, что же такое синтез. Это процесс объединения чего-либо в одно целое. Образование новой молекулы ДНК проходит в несколько этапов:
1) ДНК-топоизомераза, располагаясь перед вилкой репликации, разрезает ДНК для того, чтобы облегчить ее расплетание и раскручивание.
2) ДНК-хеликаза вслед за топоизомеразой влияет на процесс «расплетения» спирали ДНК.
3) ДНК-связывающие белки осуществляют связывание нитей ДНК, а также проводят их стабилизацию, не допуская их прилипания друг к другу.
4) ДНК-полимераза δ (дельта), согласовано со скоростью движения репликативной вилки, осуществляет синтез ведущей цепи дочерней ДНК в направлении 5'→3' на матрице материнской нити ДНК по направлению от ее 3'-конца к 5'-концу (скорость до 100 пар нуклеотидов в секунду). Этим события на данной материнской нити ДНК ограничиваются.
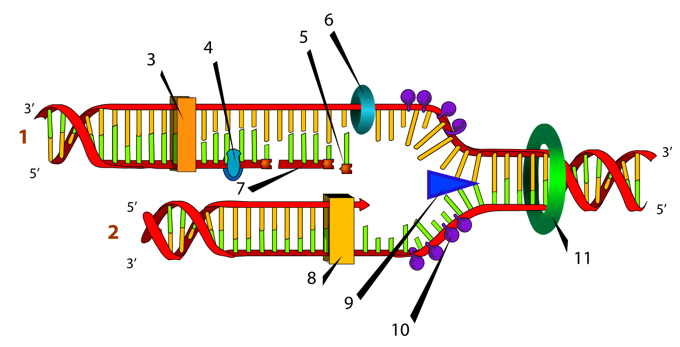
13. Первичная и вторичная структуры РНК. Типы РНК, строение, локализация в клетке, функции. Биосинтез РНК (транскрипция).
14. Рибонуклеиновая кислота (РНК) — одна из трёх основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов.
15. Так же, как ДНК, РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Однако в отличие от ДНК, РНК обычно имеет не две цепи, а одну. Пентоза в РНК представлена рибозой, а не дезоксирибозой (у рибозы присутствует дополнительная гидроксильная группа на втором атоме углевода). Наконец, ДНК отличается от РНК по составу азотистых оснований: вместо тимина (Т) в РНК представлен урацил (U), который также комплементарен аденину.
16. Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.
17. Клеточные РНК образуются в ходе процесса, называемого транскрипцией, то есть синтеза РНК на матрице ДНК, осуществляемого специальными ферментами - РНК-полимеразами.
18. Затем матричные РНК (мРНК) принимают участие в процессе, называемом трансляцией, т.е. синтеза белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК.
19. 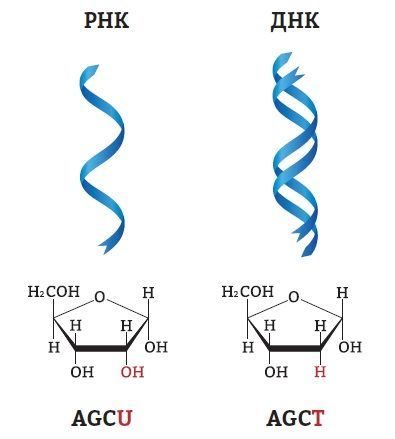
20. Рис. 10. Отличие ДНК от РНК по азотистому основанию: вместо тимина (Т) в РНК представлен урацил (U), который также комплементарен аденину.
21. ТРАНСКРИПЦИЯ
22. Транскрипция – это процесс синтеза РНК на матрице ДНК. ДНК раскручивается на одном из участков. На одной из цепей содержится информация, которую необходимо скопировать на молекулу РНК – эта цепь называется кодирующей. Вторая цепь ДНК, комплементарная кодирующей, называется матричной. В процессе транскрипции на матричной цепи в направлении 3’ – 5’ (по цепи ДНК) синтезируется комплементарная ей цепь РНК. Таким образом, создается РНК-копия кодирующей цепи.
23. 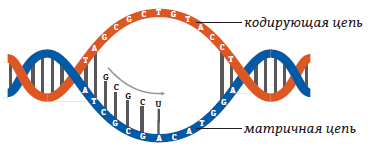
24. Рис. 11. Схематическое изображение транскрипции
25. Например, если нам дана последовательность кодирующей цепи
26. 3’– ATGTCCTAGCTGCTCG – 5’,








