Вопросы для самоконтроля
1. Какие электроды относят к индикаторным электродам? Приведите условную форму записи этих электродов и уравнения электродных реакций. Укажите достоинства и недостатки каждого из них.
2. Рассчитайте значения потенциалов водородного и хингидронного электродов в буферном растворе, содержащем 25 мл 0,1 М раствора уксусной кислоты и 50 мл 0,01 М раствора ацетата натрия.
3. В чем заключается сущность метода потенциометрического измерения рН растворов?
4. Укажите возможные сочетания электродов, используемых при потенциометрическом методе измерения pH раствора.
5. ЭДС цепи, составленной из насыщенного каломельного и хингидронного электродов, в исследуемом растворе равна 0,274 В при 298 K. E кал =0,24 В, 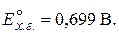 Рассчитайте рН исследуемого раствора. Диффузионным потенциалом пренебречь.
Рассчитайте рН исследуемого раствора. Диффузионным потенциалом пренебречь.
6. Составьте электрохимическую цепь, ЭДС которой равна:
а) потенциалу цинкового электрода в растворе сульфата цинка;
б) потенциалу медного электрода в растворе сульфата меди.
Приложение Предельные подвижности ионов в водном растворе
при 25 °C, Ом-1 × м2 ×моль-экв-1
| Катионы | 
| Анионы | 
|
| H+ | 349.8 | OH- | 198.3 |
| Li+ | 38.68 | F- | 55.40 |
| Na+ | 50.10 | Cl- | 76.35 |
| K+ | 73.50 | Br- | 78.14 |
| Rb+ | 77.81 | I- | 78.84 |
| Ag+ | 61.90 | 
| 64.60 |
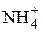
| 73.55 | 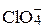
| 67.36 |
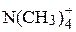
| 44.92 | 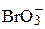
| 55.74 |
| 1/2 Mg2+ | 53.05 | CN- | 78,00 |
| 1/2 Ca2+ | 59.50 | 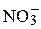
| 71.46 |
| 1/2 Ba2+ | 63.63 | CH3COO- | 40.90 |
| 1/2 Zn2+ | 56.60 | C6H5OO- | 35.80 |
| 1/2 Cd2+ | 54,00 | 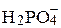
| 36,00 |
| 1/3 Al3+ | 63,00 | 1/2 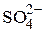
| 80.02 |
| 1/3 Lа3+ | 69.70 | 1/2 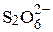
| 93,00 |
Константы (Kд) и степени диссоциации ( a ) кислот и оснований
| Кислота | pKд | Kд | a (%) в 0,1 М растворе | |
| 1 | 2 | 3 | 4 | |
| HCOl4 | -10 | 1,0 × 1010 | 100 | |
| HCl | -7 | 1,0 × 107 | 100 | |
| H2SO4 | -3 | 1,0 × 103 | 100 | сильные |
| H3O+ | -1,74 | 55 | - | |
| HNO3 | -1,32 | 21 | 99,5 | |
| HClO3 | 0 | 1 | 91 | |
| H2SO3 | 1,92 | 0,012 | 29,2 | |
HSO 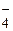
| 1,92 | 0,012 | 29,2 | |
| H3PO4 | 1,96 | 0,011 | 28,1 | |
Fe(H2O) 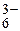
| 2,22 | 6,0 × 10-3 | 21,4 | средние |
| HF | 3,13 | 7,2 × 10-4 | 8,1 | |
| HNO2 | 3,15 | 7,1 × 10-4 | 8,0 | |
| HCOOH | 3,70 | 7,1 × 10-4 | 4,6 | |
| CH3COOH | 4,75 | 1,8 × 10-5 | 1,3 | |
Al(H2O) 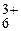
| 4,85 | 1,4 × 10-5 | 1,2 | |
| C2H5COOH | 4,89 | 1,3 × 10-5 | 1,2 | |
| H2CO3 | 6,52 | 3,0 × 10-7 | 0,17 | слабые |
| H2S | 6,92 | 1,2 × 10-7 | 0,11 | |
H2PO 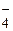
| 7,12 | 7,6 × 10-8 | 0,08 | |
| HClO | 7,25 | 5,6 × 10-8 | 0,08 | |
| HCN | 9,00 | 1,0 × 10-9 | 0,01 | |
NH 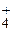
| 9,25 | 5,6 × 10-10 | 7,6 × 10-3 | |
| H4SiO4 | 9,5 | 3,2 × 10-10 | 5,6 × 10-3 | очень слабые |
Zn(H2O) 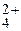
| 9,61 | 2,5 × 10-10 | 5,0 × 10-3 | |
HCO 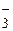
| 10,4 | 4,0 × 10-11 | 1,1 | |
HPO 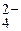
| 12,3 | 4,8 × 10-13 | 0,25 | |
| 1 | 2 | 3 | 4 | |
| H2O | 15,74 | 1,8 × 10-16 | 1,8 × 10-7 | |
| NH3 | 23 | 1,0 × 10-23 | - | сверхслабые |
| OH- | 24 | 1,0 × 10-24 | - | |
| Основание | pK0 | K0 | ||
| NH3 | 4,75 | 1,8 × 10-5 | 1,3 | |
| CH3NH2 | 3,36 | 4,4 × 10-4 | 6,6 | |
| Al(OH)3 | 8,86 | 1,4 × 10-9 | 0,001 | |








