Электрохимические методы исследования
СЕМИНАР 4
ЭЛЕКТРОХИМИЯ И
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Растворы электролитов. Теории электролитов. Теория электролитической диссоциации С. Аррениуса, ее достоинства и недостатки. Теория сильных электролитов Дебая-Хюккеля. Уравнение Дебая-Хюккеля (I приближение), использование его для определения активности ионов.
Электропроводность растворов электролитов: удельная, молярная, эквивалентная; факторы, от которых они зависят. Метод измерения электропроводности. Подвижность ионов и их абсолютная скорость движения. Закон Кольрауша. Практическое использование измерения электропроводности. Кондуктометрическое титрование, использование его в медико-биологических исследованиях.
Физикохимия электродных процессов. Механизм образования двойного электрического слоя на границе раздела металл / раствор. Электродный потенциал, зависимость его от температуры и концентрации раствора. Уравнение Нернста.
Классификация электродов: а) по устройству: I, II рода и окислительно-восстановительные; б) по назначению: электроды сравнения (стандартный водородный, хлоридсеребряный, каломельный); индикаторные электроды (водородный, хингидронный, стеклянный).
Гальванические элементы: химические, концентрационные. Теоретический расчет ЭДС гальванических элементов.
Применение метода ЭДС. Электрометрический метод измерения pH растворов. Потенциометрическое титрование.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Электрохимия - это раздел физической химии, изучающий закономерности взаимопревращений электрической и химической форм энергии. В химических реакциях, идущих под действием электрического тока (т. е. при электролизе), электрическая энергия превращается в химическую. В гальванических элементах электрическая энергия вырабатывается в результате протекания химических реакций. Общей чертой электрохимических процессов является участие в них двух соприкасающихся фаз, между которыми происходит материальный обмен молекулами или ионами. Все эти процессы идут в растворах или расплавах электролитов и связаны с изменением состояния ионов. Поэтому в электрохимии изучаются свойства растворов электролитов, ионные равновесия, электродные процессы.
1. Электропроводность растворов электролитов
Электролитами называются вещества, растворы или расплавы которых обладают ионной проводимостью. По сравнению с металлами (сплавами металлов), проявляющими электронную проводимость и являющимися проводниками первого рода, электролиты относят к проводникам второго рода. Типичные проводники второго рода – это растворы кислот и оснований, расплавы и растворы солей. Так как все биологические жидкости и ткани организма обладают ионной проводимостью, то они относятся к проводниеам второго рода.
Важным свойством растворов электролитов является электрическая проводимость (электропроводность), которая характеризует их способность проводить электрический ток. Она является величиной, обратной электрическому сопротивлению. В свою очередь, сопротивление проводника любого вида R, согласно закону Ома, пропорционально его длине (l) и обратно пропорционально площади сечения (S):
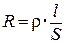 , , 
| (6.1) |
где ρ – удельное сопротивление, равное R при единичных длине и сечении проводника, Ом.м.
Различают удельную, эквивалентную и молярную электропроводности. Величина, обратная удельному сопротивлению (r), называется удельной электропроводностью (k, «каппа») и представляет собой электропроводность раствора электролита, помещенного между параллельными электродами площадью 1 м2, находящимися на расстоянии 1 м.
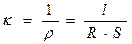 , Ом-1×м-1 (См×м-1). , Ом-1×м-1 (См×м-1).
| (6.2) |
В растворах отношение усредненного пути движения ионов к площади их перемещения 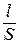 называют постоянной сосуда (Z). Величину Z нельзя найти простым измерением l и S, т.к. путь движения ионов в электродном пространстве трудно измерить из-за его сложности, а фактическая поверхность платинированных электродов больше геометрической поверхности. В связи с этим постоянную сосуда (Z) определяют измерением сопротивления стандартных растворов с точно известным значением удельной электропроводности (обычно используют растворы хлорида калия определенной концентрации). Тогда Z = kKCl ×RKCl или в общем виде
называют постоянной сосуда (Z). Величину Z нельзя найти простым измерением l и S, т.к. путь движения ионов в электродном пространстве трудно измерить из-за его сложности, а фактическая поверхность платинированных электродов больше геометрической поверхности. В связи с этим постоянную сосуда (Z) определяют измерением сопротивления стандартных растворов с точно известным значением удельной электропроводности (обычно используют растворы хлорида калия определенной концентрации). Тогда Z = kKCl ×RKCl или в общем виде
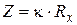
| (6.2а) |
Зная постоянную сосуда и сопротивление исследуемого раствора, рассчитывают удельную электропроводность по формуле:
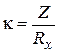
| (6.2б) |
Для характеристики электропроводности растворов электролитов чаще используют молярную или эквивалентную электропроводность (λ, «ламбда»), т. е. электропроводность раствора, содержащего 1моль ( или 1 моль-экв) электролита соответственно, помещенного между параллельными электродами, расположенными на расстоянии 1 м. "Рабочая" площадь электродов определяется объемом раствора. Молярная (эквивалентная) электропроводность связана с удельной электропроводностью следующим соотношением:
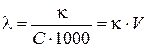 ,Ом-1×м2 ×моль-1 ( или Ом-1×м2 моль-экв-1), ,Ом-1×м2 ×моль-1 ( или Ом-1×м2 моль-экв-1),
| (6.3) |
где С – молярная концентрация (или молярная концентрация эквивалента) раствора, моль/л; V – разведение (разбавление) раствора, т. е. объем раствора, в котором растворен один моль или один моль-эквивалент электролита, м3/моль или м3/моль-экв.
Если между электродами, расположенными на расстоянии 1 м друг от друга, содержится 1 моль электролита, то электропроводность раствора называется молярной.
 Электропроводность растворов зависит от ряда факторов: природы растворителя, вязкости и температуры среды, радиуса и концентрации ионов в растворе. На кривых зависимости удельной электропроводности от концентрации (рис. 6.1) обычно наблюдается максимум.
Электропроводность растворов зависит от ряда факторов: природы растворителя, вязкости и температуры среды, радиуса и концентрации ионов в растворе. На кривых зависимости удельной электропроводности от концентрации (рис. 6.1) обычно наблюдается максимум.
 |
Рис. 6.1. Зависимость удельной электропроводности от концентрации для некоторых электролитов
С увеличением концентрации раствора удельная электропроводность сначала растет за счет увеличения числа ионов, достигая максимального значения. При дальнейшем увеличении концентрации сильных электролитов межионное взаимодействие возрастает настолько сильно, что приводит к снижению скорости движения ионов и уменьшению величины удельной электропроводности раствора. В растворе слабых электролитов скорость движения ионов мало зависит от концентрации, однако с увеличением концентрации раствора уменьшается степень диссоциации, что также приводит к уменьшению величины удельной электропроводности.
Молярная (эквивалентная) электропроводность растворов электролитов при разбавлении раствора (уменьшении концентрации) увеличивается (рис. 6.2), достигая при бесконечном разбавлении максимального и постоянного значения.
 |
Рис. 6.2. Зависимость молярной электропроводности от разбавления для некоторых электролитов
Это значение является определенным для каждого электролита и называется эквивалентной электропроводностью при бесконечном разбавлении, обозначается λ¥. В разбавленных растворах сильных электролитов выполняется эмпирический закон Кольрауша (закон квадратного корня):
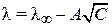 , ,
| (6.4) |
где А – константа (при данной температуре) для данного электролита и растворителя.
Электропроводность электролитов связана со скоростями движения ионов в растворе. В бесконечно разбавленном растворе достигается полная диссоциация молекул и взаимодействие между ионами отсутствует. Каждый из ионов движется независимо от других и молярная (эквивалентная) электропроводность в таком случае может быть представлена как сумма электропроводностей ионов. Та часть электропроводности, которая приходится на ионы одного вида, называется подвижностью иона.
Согласно закону Кольрауша о независимости движения ионов, величина l ¥ равна сумме подвижностей катиона ( l k ) и аниона ( l a ):
| λ¥ = l k + l а. | (6.5) |
Физический смысл закона Кольрауша заключается в том, что в растворе электролита ионы переносят электрический ток независимо друг от друга.
Значения подвижностей катиона и аниона даются в справочных таблицах. Эти величины называют также молярные электрические проводимости ионов.
Подвижности ионов связаны с абсолютными скоростями движения ионов (U):
| lk = F × Uk; la = F × Ua. | (6.6) |
Под абсолютной скоростью движения ионов понимают скорость их движения при градиенте напряженности электрического поля 1 В/м. Сравнение абсолютных скоростей движения различных ионов или их подвижностей показало, что они зависят от заряда и радиуса иона. Чем больше заряд и радиус иона и чем выше степень его гидратации, тем меньше подвижность. При этом было установлено также увеличение скорости движения ионов одинакового заряда с ростом кристаллографического радиуса Li+< Na+< K+< Rb+< Cs+, что объясняется гидратированием ионов в водных растворах, причем ионы меньшего радиуса гидратируются в большей степени.
Предельные подвижности ионов водорода и гидроксид-ионов в водных растворах в несколько раз превышают подвижности других ионов. Это явление объясняется особым эстафетным механизмом их движения. Согласно которому в кислой среде осуществляется перенос протона от иона гидроксония к соседней, соответствующим образом ориентированной, молекуле воды:
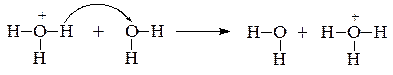
Аналогический перенос протона от молекулы воды к иону гидроксида происходит в щелочной среде:
 |
Таким образом, при наложении электрического поля происходит не просто перемещение ионов H+ и OH-, а скачкообразный переход протона от H3O+ или нейтральных молекул воды к соседним молекулам. В связи с тем, что отрыв протона от иона гидроксония происходит легче, чем от нейтральных молекул воды, подвижность ионов H+ больше, чем подвижность ионов OH-.
В растворах слабых электролитов молярная электропроводность при данном разбавлении (ln) пропорциональна степени его диссоциации ( 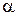 ):
):
| ln = a× l¥. | (6.7) |
Степень диссоциации слабого электролита можно рассчитать по уравнению Аррениуса:
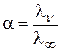 . .
| (6.8) |
Значение ln определяют экспериментально, а l¥ рассчитывают по справочным таблицам, пользуясь уравнением (6.5).
Кроме того, для слабых электролитов выполняется закон разведения Оствальда, который для бинарного электролита записывается следующим образом:
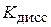 = = 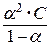 . .
| (6.9) |
Подставляя значение a в уравнение (6.9), получают еще одну из форм закона разведения Оствальда для расчета константы диссоциации:
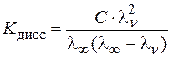 . .
| (6.10) |
2. Электродные потенциалы. Электродвижущие силы
В гетерогенных системах, содержащих заряженные частицы, на границе раздела фаз неизбежно возникает разность электрических потенциалов. Например, при погружении металлической пластинки в воду (или в раствор соли данного металла) наблюдается обмен ионами между твердой и жидкой фазами. При этом на границе раздела металл-раствор в результате протекания реакции
Men+ + n 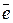
 Me0
Me0
образуется двойной электрический слой (ДЭС) и возникает скачок потенциала, называемый электродным потенциалом.
Измерить абсолютное значение электродного потенциала невозможно. Задача практического определения электродного потенциала была решена путем использования условной шкалы, в которой потенциалы исследуемых электродов сопоставляют с потенциалом электрода сравнения. В качестве такого электрода сравнения был выбран стандартный водородный электрод, электродный потенциал которого условно принят за нуль. Согласно правилам ИЮПАК электродным потенциалом считается электродвижущая сила (ЭДС) элемента, в котором слева расположен стандартный водородный электрод, а справа - исследуемый электрод. Электродный потенциал обозначается также как и ЭДС, т. е. буквой Е. (Допускается обозначение потенциалов: ε, φ )
Количественная зависимость между величиной электродного потенциала (Е, В) и активностью ионов данного металла ( 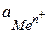 , моль/л) выражается уравнением Нернста:
, моль/л) выражается уравнением Нернста:
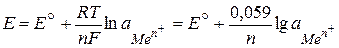 , ,
| (6.11) |
где E° - стандартный (нормальный) электродный потенциал, В; R – универсальная газовая постоянная, 8,314 Дж/(моль.К); Т – температура, К; n - валентность ионов данного металла; F - число Фарадея, 96 500 Кл/моль.
Стандартным электродным потенциалом (E°) называется потенциал электрода при активности ионов данного металла, равной 1 моль/л. Потенциалы электродов измеряют по отношению к стандартному водородному электроду.
Стандартный водородный электрод представляет собой платиновую пластинку с развитой поверхностью, погруженную в раствор кислоты при активности ионов H+ в растворе равной единице, и контактирующих с газообразным водородом, давление которого равно 0,1013 МПа (1 атм).
Различают электроды первого и второго рода. В электродах первого рода восстановленной формой является металл электрода, а окисленной формой – ионы этого металла. Как правило, электроды первого рода обратимы либо относительно катиона, либо - аниона (т. е. их потенциал является функцией активности либо только катиона, либо только аниона). К электродам первого рода относятся медный (CuSO4 | Cu), цинковый (ZnSO4 | Zn), хлорный (Cl-| Cl2 | Pt), кислородный (O2-| O2 | Pt ) и др.
Электродами второго рода могут служить системы, в которых металл электрода покрыт труднорастворимой солью этого металла и опущен в раствор, содержащий хорошо растворимый электролит с одноименным анионом. Окисленной формой в таких электродах является труднорастворимая соль, а восстановленной – металл и анион соли. Электроды второго рода обратимы как относительно катиона, так и аниона (т. е. их потенциал является функцией активности как катиона, так и аниона). Примерами электродов второго рода являются:
каломельный (KCl(р-р) | Hg2Cl2 | Hg),
хлоридсеребряный (KCl(р-р)| AgCl | Ag).
Существуют также электроды, которые не обмениваются с растворами ни катионами, ни анионами, а только обеспечивают подвод и отвод электронов для окислительно-восстановительной реакции, протекающей в растворе. Они называются окислительно-восстановительными (или редокс-электродами) и представляют собой пластинку из инертного металла (например, платиновую), опущенную в раствор, содержащий окисленную и восстановленную формы какого-либо вещества. Например, Fe2+, Fe3+ | Pt.
Электроды, имеющие устойчивый потенциал и используемые для определения потенциалов других электродов, называются электродами сравнения. К ним относятся стандартный водородный (Н+| Н2 | Pt), каломельный, хлоридсеребряный.
Потенциал некоторых электродов зависит от активности ионов водорода в растворе, т. е. от pH раствора:
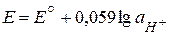 . .
| (6.12) |
Такие электроды называют индикаторными. Широкое применение в качестве индикаторных электродов получили водородный (не стандартный), стеклянный, хингидронный (H+ | C6H4O2, C6H4(OH)2 | Pt) электроды, которые используются для определения pH различных биологических жидкостей, почвенных растворов, молочных и других пищевых продуктов. Например, для определения рН исследуемого раствора потенциометрическим методом составляют гальванический элемент, в котором в качестве индикаторного электрода используют стеклянный, а в качестве электрода сравнения – хлоридсеребряный электроды.
Схема данного гальванического элемента имеет вид:
(–) Ag | AgCl | HCl (0,1 моль/л) | стеклянная | H+ | KCl (нас) | AgCl | Ag (+)
мембрана
14444444444244444443 123 144444442443
стеклянный исследуемый хлоридсеребряный
электрод раствор электрод
ЭДС цепи определяют по уравнению :
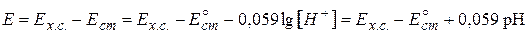 . .
|
Электрохимические цепи – системы, состоящие из двух электродов, помещенных в раствор электролита или в два разных раствора, находящихся в контакте друг с другом. Электрохимические цепи, способные вырабатывать электрическую энергию за счет окислительно-восстановительной химической реакции, называют гальваническими элементами.
Различают химические и концентрационные гальванические элементы (или цепи). Примером химического гальванического элемента может служить элемент Якоби - Даниэля, состоящий из медного и цинкового электродов, погруженных в растворы своих растворимых солей. Для гальванического элемента принята следующая форма записи:
Zn | ZnSO4 || CuSO4 | Cu,
где одинарная сплошная вертикальная линия обозначает границу раздела между разными фазами (металл – раствор), а двойная вертикальная линия – границу между двумя жидкими фазами (растворами солей) при отсутствии диффузионного потенциала.
При замыкании электродов во внешней цепи слева направо движутся электроны, а в растворе - катионы. Это означает, что на левом электроде идет процесс окисления, а на правом - восстановления. Суммарное уравнение реакции, протекающей при работе данного элемента, имеет вид
Zn + Cu2+ = Zn2++ Cu.
Вследствие неодинаковой подвижности ионов электролита на границе раздела двух жидких фаз возникает разность потенциалов, называемая диффузионным потенциалом. Для его устранения между растворами солей помещают электролитический (солевой) мостик с электролитом, подвижности ионов которого близки (например, KCl, NH4Cl).
Максимальная разность потенциалов, достигаемая при обратимой работе гальванического элемента, называется электродвижущей силой (ЭДС, E) элемента (цепи). Величина ЭДС элемента равна разности значений потенциалов положительного (правого) и отрицательного (левого) электродов. При этом значение E будет всегда положительным. Для элемента Якоби-Даниэля ЭДС вычисляют по формуле:
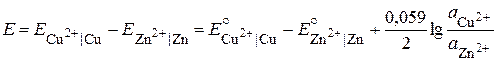 , ,
| (6.13) |
где 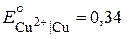 В,
В, 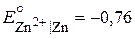 В.
В.
Таким образом, работа химических гальванических элементов происходит за счет процессов окисления-восстановления, протекающих раздельно на каждом электроде. Комбинируя различные окислительно-восстановительные полуреакции, можно получить большое число гальванических элементов.
В концентрационных элементах электрическая энергия образуется за счет выравнивания концентраций растворов. Для изготовления концентрационного элемента пластинки из одного и того же металла погружают в растворы его соли различной концентрации. Например,
Ag | AgNO3 (C1) || AgNO3 (C2) | Ag, C1 < C2.
ЭДС концентрационного элемента можно вычислить по формуле:
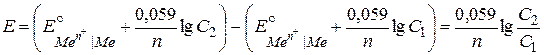 . .
| (6.14) | |








