Эпизоотическкая ситуация по анаплазмозу крупного рогатого скота в Кильмезском районе.
Министерство сельского хозяйства РФ
ФГБОУ ВО Вятская ГСХА
Факультет ветеринарной медицины
Кафедра хирургии, акушерства и заразных болезней
КОНТРОЛЬНАЯ РАБОТА
| Выполнил(а): | Макарова Татьяна Анатольевна |
| Фамилия, Имя, Отчество | |
| студент(ка) факультета ветеринарной медицины заочной формы обучения по специальности 36.05.01 «Ветеринария», курс 5, группа ВВз-510 |
| Дисциплина: | Паразитология и инвазионные болезни |
| Тема (вариант): | Вариант № 7 |
| Проверил(а) | Скорнякова Ольга Олеговна |
Фамилия, Имя, Отчество преподавателя
| Регистрационный номер на кафедре: ______________ | |
| Дата регистрации: «_____» ________________ 201__ | |
| Результат проверки: __________________________ |
г. Киров, 2019
Содержание
1.Эстроз овец……………………………………………………………………2
2.Диктиокаулез крупного рогатого скота…………………………………….4
3.Роль отечественных ученых в развитии гельминтологии ………………12
4.Эпизоотическая ситуация в отношении инвазионных заболеваний (по данным исследований) всех видов животных в обслуживаемом хозяйстве (или зоне).Мероприятия ,проводимые по борьбе с ними…………………14
5.Список литературы…………………………………………………………30
6.Приложения
1.Эстроз овец
Эстроз овец - оводовое заболевание, вызываемое личинками овечьего овода (Oestrus ovis) из сем. Oestridae, которые паразитируют в полостях головы (носовой, лобной и др.). Личинки овечьего овода инвазируют и коз. Болезнь причиняет большой ущерб хозяйствам, особенно в районах развитого овцеводства, преимущественно за счет снижения мясной и шерстной продуктивности, а также падежа части больных овец.
Возбудитель. Овечий овод небольшого размера (9-12 мм длины) . Голова и грудь окрашены в коричнево-серый цвет, брюшко желтовато-серое. Крылья небольшие, прозрачные. Личинки III стадии достигают 30 мм длины, имеют крупные при ротовые крючья (органы фиксации); мелкие шипы, расположены в несколько рядов только на вентральной и боковых частях тела личинок.
Жизненный цикл. Самки овода после оплодотворения в течение 1,5-3 недель находятся в состоянии покоя. В это время они малоподвижны, сидят в углублениях и щелях, на стенах построек. После созревания личинок самки активно летают вблизи овец и на лету впрыскивают им в ноздри личинок порциями (по 12-20 экз.). Активность самок проявляется при температуре воздуха выше 16°.
Полет оводов сопровождается звуком, который вызывает беспокойство у животных. Защищаясь от нападения оводов, овцы собираются в группы, опускают головы к земле. За несколько дней самки оводов выделяют до 400-600 личинок. В поисках овец оводовые самки могут отлетать от места выплода до 3-3,5 км. После длительного паразитирования (6-10 мес.) в придаточных полостях головы личинки третьей фазы выпадают наружу и окукливаются в почве. Имаго формируется через 3-4 недели. В северном ареале овечьего овода развивается одна, а в южном - две генерации.
Эпизоотологические данные. Отмечено, что чем больше сконцентрировано на пастбище овец, тем больше они инвазированы личинками овечьего овода. В засушливое и жаркое лето вследствие сильного прогревания почвы и повышения ее твердости большое количество личинок не зарывается в почву и гибнет.
Патогенез. В носовой полости личинки овечьего овода раздражают слизистую оболочку, что вызывает ответную реакцию овец в виде фырканья. Поэтому на слизистой удерживается не более 10-15% личинок. Инвазированность носовых и придаточных полостей может достигать 50 экз. и больше личинок, которые своими шипиками и крючками травмируют слизистую носовых и придаточных полостей, в результате чего она воспаляется.
Течение воспалительного процесса осложняется гноеродной инфекцией. При осложнении инвазионного процесса в организме овец меняется морфологический и биохимический состав крови, нарушаются физиологические функции органов и центральной нервной системы. При самоотхождении личинок или их уничтожении инсектицидами животные выздоравливают.
Клинические признаки. В начале заражения овец личинками овечьего овода животные беспокоятся. Овцы группируются, фыркают, а затем из ноздрей появляются серозные и слизистые выделения. В дальнейшем явления острого ринита усиливаются: носовые истечения становятся обильными, область носа опухшая. Впоследствии носовые выделения подсыхают и превращаются в корки, которые суживают носовые отверстия, и у овец появляется сопящее дыхание. У многих животных опухают подчелюстные лимфоузлы, а у некоторых повышается температура, ухудшается общее состояние, нарушается координация движений. Возможен летальный исход.
Диагноз предварительный устанавливают по указанным выше клиническим признаками. Окончательный диагноз ставят при обнаружении гигрирующих личинок в носовой полости или по результатам вскрытия носовых и придаточных полостей головы трупов павших или туш убитых овец. На овцефермах нередко отмечают сходство симптомов эстроза и ценуроза. Дифференциация этих двух заболеваний основывается на том, что при ценурозе отсутствует ринит и отмечают размягчение костей головы в месте нахождения ценурозного пузыря.
Меры борьбы и Профилактика. В борьбе с эстрозом овец и коз проводят раннюю химиотерапию путем применения растворов или аэрозолей ДДВФ и хлорофоса. Личинок овечьего овода в носовых полостях можно уничтожать методом орошения из ирригатора двухрожкового носового (ИДН) 4%-ным раствором хлорофоса в дозе 20- 25 мл.
Менее трудоемким и эффективным методом является аэрозольная дезинсекция овец. При наличии герметичных овчарен раннюю терапию эстроза осуществляют групповым методом.
Для обработки овец пользуются ветеринарной дезинфекционной машиной (ВДМ) с различными форсунками (ПВАН и ТАН), а также применяют аэрозольные балончики заводского изготовления. В овчарне одним балончиком «Эстрозоля» обрабатывают 400 м3. Работают с аэрозолями в противогазе с патроном марки «А» и со всеми предосторожностями, как при работе с ядами. Против эстроза овец обрабатывают однократно: в средней полосе - сентябрь - октябрь, на юге - октябрь - ноябрь. После обработки овец аэрозолем ДДВФ убой животных разрешается через 5 дней, аэрозолем хлорофоса - через 7 дней, а после интраназального орошения - через 3 дня.
2.Диктиокаулез крупного рогатого скота
Диктиокаулез: возбудителем этого заболевания является нематода Dictyocaulus viviparus, относящаяся к семейству Dictyocaulidae и паразитирующая в бронхах и трахее крупного рогатого скота. Диктиокаулез - заболевание по преимуществу молодняка в возрасте от 4 до 18 месяцев, хотя иногда он встречается и у взрослых животных. Нередко оно протекает в форме энзоотии и завершается смертью заболевших телят.
У самца, длиной от 17 до 43 мм, при максимальной ширине от 0,4 до 0,7 мм, хвостовой конец снабжен кутикулярной бурсой с характерным взаиморасположением ребер (рис. 128). Две спикулы, 0,22 - 0,27 мм длины и 0,048 мм ширины, буровато-желтоватого цвета, имеют ноздреватую структуру, а рулек, 0,06 - 0,08 мм длины, - ячеистую.
У самки, длиной 23 - 58 мм, при максимальной ширине 0,4 - 0,6 мм вульва расположена близ середины тела. Эллипсоидной формы яйца достигают 0,085 мм длины и 0,051 мм ширины.
Развитие возбудителя. Оплодотворенные самки откладывают яйца в бронхах и трахее рогатого скота, которые затем попадают им в рот и проглатываются со слюной. Во время прохождения через пищеварительный тракт, главным образом в толстом отделе кишечника, из яиц выходят личинки; последние с калом выбрасываются во внешнюю среду.
При наличии соответствующих условий личинки, развиваясь, проделывают две линьки, легко определяемые по отслоению на переднем и заднем конце тела оболочек. Только после этого они достигают третьей, или инвазионной, стадии развития, способной вызвать заражение. Необходимый для этого срок всецело зависит от температуры окружающего личинок воздуха и влажности среды, в которой они находятся: при 25° (оптимальная температура) он равен трем суткам, а при более низкой температуре он соответственно удлиняется и может достигать 11 и более суток. Когда температура опускается ниже 10° или бывает выше 30°, не наблюдается развития личинок до инвазионной стадии.
Проглоченные телятами с кормом или питьевой водой инвазионные личинки, достигнув тонкого отдела кишечника, внедряются в его слизистую оболочку, а из нее через лимфатическую и кровеносную системы продвигаются в легкие - к месту локализации половозрелых паразитов.
В легких личинки покидают кровеносные сосуды, пробуравливая их стенки, переходят в альвеолярную систему и бронхиолы, затем перемещаются в бронхи и трахею. Срок, необходимый для достижения диктиокаулюсами половозрелой стадии, с момента проглатывания телятами инвазионных личинок до откладки развившимися из них самками яиц, равен 21 - 25 дням.
Продолжительность паразитирования диктиокаулюсов в организме телят варьирует у разных животных от 2 до 12 месяцев и зависит, во-первых, от условий содержания и кормления скота, а во-вторых, от физиологического состояния организма хозяина: у упитанного животного он короткий, а у истощенного длинный. Улучшением условий содержания и кормления можно сократить срок паразитирования диктиокаулюсов.
Эпизоотология: Диктиокаулез крупного рогатого скота, в особенности телят, распространен повсеместно. Источником заражения скота всех возрастов являются животные - носители этой инвазии и скопления личинок паразита во внешней среде. Заражаются телята по преимуществу на пастбище и иногда, при наличии соответствующих температуры и влажности, - в стойлах. Личинки выделяются во внешнюю среду с калом, в котором они достигают инвазионной стадии. Но чтобы попасть в организм животного, они должны освободиться из кала, чему способствуют дожди, вымывая и разнося зародышей по пастбищу, а также туманы и росы, создавая капиллярные токи воды. Некоторые исследователи допускают наличие у личинок активного поступательного движения на расстояние до 0,5 м; по мнению других, расселению личинок по пастбищу способствуют различные насекомые (копрофаги). Однако существование двух последних источников заражения нуждается в экспериментальном подтверждении.
Заражение скота осуществляется как в результате поедания травы, загрязненной личинками диктиокаулюсов, так и после приема воды из пастбищных луж, содержащей этих зародышей.
Во внешней среде во влажных камерах личинки при 18 - 24° выживают до 3 - 4 недель, а при 10 - 14° - до 2 и даже до 3 месяцев. Высушивание и замораживание легче переносят личинки третьей стадии (инвазионные), чем личинки первой стадии, не претерпевшие линьки. Так, последние, будучи высушены при температуре 20° и 62% относительной влажности воздуха, погибают через 5 минут, а первые при тех же условиях погибают через 5 суток. Личинки первой стадии, замороженные при - 12°, погибают через 24 часа, тогда как личинки третьей стадии, замороженные при - 17°, погибают только на третьи сутки.
Инвазионные личинки также более устойчивы, чем неинвазионные, к органическим и неорганическим химическим веществам; однако для целей дезинвазии внешней среды в отношении личинок диктиокаулюсов надежных химических средств пока еще не найдено.
Большое эпизоотологическое значение имеет вопрос, происходит ли за зиму стерилизация пастбищ, инвазированных осенью личинками диктиокаулюсов. Одни исследователи (Б. Я. Тахистов, 1951) утверждают, что личинки благополучно перезимовывают и поэтому они могут служить источником заражения телят диктиокаулезом ранней весной; другие, наоборот, считают, что личинки за осенне-зимне-весенний период погибают, ввиду чего пастбища становятся стерильными в отношении личинок диктиокаулюсов к началу следующего выпасного сезона. Не отрицая возможности перезимовывания личинок в отдельных случаях, следует, однако, признать, что этот источник заражения ничтожен и, по существу, практического значения иметь не может. Таким образом, при построении профилактических мероприятий можно исходить из положения, что за зиму пастбища стерилизуются в отношении личинок диктиокаулюсов.
Диктиокаулез - сезонное заболевание, получающее наибольшее распространение главным образом летом. Телята текущего года рождения и другие возрастные группы крупного рогатого скота, заражаясь с мая - июня во все возрастающем количестве, достигают кульминационной точки инвазированности, как правило, к августу - сентябрю. В это время резко проявляется и клиника болезни. Затем последняя естественно угасает, и к зимним месяцам остается сравнительно небольшой процент зараженных животных (большей частью в форме носительства)
Патогенез. Личинки диктиокаулюсов, чтобы попасть к месту локализации половозрелых паразитов, травмируют слизистую оболочку тонкого отдела кишечника, лимфатические узлы, лимфатические и кровеносные сосуды, а также стенки альвеолов, бронхиол и. мелких бронхов.
Помимо этого, подрастающие или уже половозрелые паразиты могут закупорить мелкие бронхи, вследствие чего возникает ателектаз преимущественно в задних долях легкого, а при наличии большого количества гельминтов, свернувшихся в клубок, - закупорка крупных бронхов или гортани, ведущая иногда к гибели животных от удушения.
Как следствие интоксикации, наблюдается раздражение слизистой оболочки и бронхиальных слизистых желез, влекущее за собой выделение большого количества слизи, гиперемию, набухание слизистой оболочки, прогрессивное исхудание, температурную реакцию, угнетение и ряд других симптомов.
Мигрирующие личинки, разрушая целость кишечной стенки, кровеносных и лимфатических сосудов и легочной ткани, открывают доступ патогенной микрофлоре кишечника и легких в кровяное русло, а вместе с тем в другие органы и ткани, способствуя развитию вторичной инфекции. Обусловленные диктиокаулюсами ателектазы служат благоприятной средой для развития микроорганизмов и соответствующих воспалительных, гнойных и некротических процессов.
Симптомы. Первый и более или менее постоянный симптом диктиокаулеза - это кашель. Вначале редкий и сухой, он в последующем становится более частым и влажным, нередко сопровождаясь слизистым истечением из ноздрей. Аппетит уменьшается или совсем исчезает. Животные худеют, становятся вялыми, отстают от стада, стараются больше лежать. Иногда температура тела поднимается до 39,5 - 40,0°; появляется одышка. При аускультации прослушиваются влажные хрипы, а при перкуссии - очаговые притупления в области 8 - 9-го межреберных промежутков.
Когда диктиокаулез осложняется гнойной пневмонией, симптомы его принимают более тяжелую форму. Болезнь часто заканчивается смертью.
Диагноз: Даже обычно ярко выраженные клинические признаки диктиокаулеза не дают основания ставить диагноз на это заболевание, поскольку такие же признаки могут быть при легочных поражениях иной этиологии. Для уточнения диагноза необходимо еще лабораторно-гельминтологическое исследование, подтверждающее наличие возбудителя диктиокаулеза. Однако и при этих условиях, т. е. при наличии гельминтов в легких и клинического' проявления болезни, далеко не исключена возможность, что основной легочный процесс вызван другой причиной, а диктиокаулюсы только в некоторой степени осложняют его. В таких случаях прибегают к дифференциальной диагностике методом исключения. Инфекционные болезни выявляются путем нахождения их возбудителя или специальными методами исследования (туберкулинизация и др.). Пневмонии, вызванные неудовлетворительными условиями содержания, характеризуются локализацией патологического процесса в передних долях легкого, тогда как при диктиокаулезе они, как правило, находятся в задних долях
При исследовании несвежего кала личинки могут оказаться в стадии линьки, т. е. покрытыми отслоившимися оболочками (одной или двумя), хорошо заметными на головном и хвостовом конце или при сгибании тела.
Обнаружение личинок в кале при отсутствии клиники болезни указывает только на гельминтоносительство. Однако к гельминтоносителям необходимо относиться, как к потенциально больным животным, ибо достаточно небольшого ухудшения условий кормления и содержания животных, чтобы носительство перешло в заболевание.
Ларвоскопическим методом можно выявлять инвазированных диктиокаулюсами животных в любое время года, за исключением зимнего сезона, когда из-за половой депрессии самок и малого количества выделяемых ими личинок последние не всегда поддаются обнаружению в фекалиях.
При извлечении кала из прямой кишки соблюдают осторожность Скаждый раз тщательно моют руки), чтобы не перенести личинок из пробы одного животного в пробу другого. Пробы, отправляемые в лабораторию, регистрируются в списках, в которых, помимо названия хозяйства, указывается номер или кличка животного, его возраст и время взятия кала.
В теплое время кал для исследования должен доставляться свежим - не позднее 6 - 8 часов после извлечения его из прямой кишки животного; в полежавшем кале могут вылупиться личинки из яиц стронгилят и сильно затруднить этим дифференциальную диагностику.
Лечение телят осуществляется введением в их трахею водного раствора йода, приготовленного по рецепту: йода кристаллического 1,0, калия йодистого 1,5, воды дестиллированной или кипяченой 1500,0. Йод сначала разводят в концентрированном растворе йодистого калия, а потом добавляют уже остальной объем воды. Готовят раствор в день употребления в темной стеклянной посуде. Вместо йода и йодистого калия можно использовать настойку йода в соответствующих количествах, чтобы получить раствор, содержащий на 1500 частей воды 1 часть кристаллического йода.
По инструкции доза раствора для телят в возрасте от 2 до 6 месяцев составляет 20 - 50 мл, а от 6 месяцев до 1 года - 50 - 75 мл.
Для получения более высокой эффективности некоторые авторы рекомендуют доводить дозу раствора до 1,0 г на 1 кг живого веса, что составляет в среднем около 80 мл для телят и 130 мл на годовиков (Попова, 1949).
Поскольку диктиокаулюсы локализуются по преимуществу в задних долях легкого, необходимо, чтобы вводимый раствор йода попал именно в эти доли. Для этого телят укладывают в спино-боковом положении на специальный станок, приподнятый в передней части под углом в 30 - 40° к горизонту. Иглу вкалывают в области верхней трети трахеи, в межкольцевое пространство. Место укола предварительно выстригают или раздвигают шерсть на нем. Обнажившуюся кожу смачивают дезинфицирующим раствором.
Инъецируемый раствор йода предварительно нагревают до 20 - 37° и вводят с осторожностью, чтобы не вызвать раздражения трахеи и кашлевой реакции, при наличии которой раствор может быть выброшен в ротовую полость и проглочен. Если сразу же после нажатия на поршень шприца появляются кашлевые толчки и после них глотательные движения, - это означает, что инъекцию нужно повторить, используя несколько меньшую дозу; если кашлевые толчки появляются несколько секунд спустя, повторная инъекция не требуется.
Курс лечения состоит из двух интратрахеальных инъекций, каждый раз в различных спинно-боковых положениях: сначала в правом и через сутки в левом, или наоборот.
Когда раствор йода вводят диктиокаулоносителям или животным, не имеющим клиники болезни, инъекции могут следовать одна за другой, т. е. сначала в одно легкое, а потом сразу же в другое; в этом случае нет необходимости снимать теленка со станка.
Перед лечением осматривают всех животных; в соответствии с выявленными результатами телятам назначают дифференцированное лечение: одним две инъекции подряд, а другим с интервалом в 1 - 2 суток, третьим снижают дозировку или откладывают лечение, пока они не окрепнут, у четвертых сочетают впрыскивания иода с введением отхаркивающих веществ и т. д. Дегельминтизированных животных первые 5 - 6 дней оставляют под ветеринарным наблюдением.
При осложнении диктиокаулеза пневмонией, бронхопневмонией и т. д. клинический эффект дегельминтизации может в первое время отсутствовать; в таких случаях прибегают к симптоматическому лечению больных телят. Хорошие результаты в этом отношении достигаются от внутривенного вливания новарсенола (0,4 - 0,6 г на теленка), приема внутрь стрептоцида по 0,5 г 3 раза в день в течение трех суток или 15 - 20 мл раствора риванола 1 : 300, с повторением при необходимости через 3 - 5 дней (А. И. Смирнов). Наибольший эффект получается, когда специфическому лечению предшествует и его сопровождает усиленное и полноценное кормление телят. Иногда даже одного этого мероприятия бывает достаточно, чтобы добиться полного выздоровления животных от диктиокаулеза.
В период лечения соблюдают профилактические меры, предотвращающие рассеивание инвазионного начала: дегельминтизацию проводят в специально отведенном месте, животных после лечения выдерживают в течение 5 - 6 дней в помещении или на специально отведенном пастбище; кал обеззараживают в навозохранилищах.
Борьба с диктиокаулезом крупного рогатого скота лечебно-профилактических мероприятий, имеющих своей конечной целью полную ликвидацию болезни. Борьбу с диктиокаулезом телят необходимо начинать с организации соответствующих зоогигиенических условий размещения, пастьбы, ухода, кормления и водопоя телят. Имеются наблюдения, что одними этими мерами удавалось не только ликвидировать, но даже предотвратить появление в хозяйстве диктиокаулезной инвазии.
Диктиокаулез - заболевание по преимуществу молодняка, следовательно, и мероприятия должны быть направлены в первую очередь на предохранение слагается из комплекса общих и специфических организационных и от заражения этой возрастной группы; основное внимание при этом уделяют устранению контакта между телятами и инвазионным началом. Это осуществляется изолированным содержанием и пастьбой телят, родившихся в текущем году, от других возрастных групп крупного рогатого скота, главным образом от молодняка предыдущего года рождения, побывавшего на пастбище. Для телят, кроме изолированных помещений и пастбищ, выделяют отдельные прогоны к ним. В пастбищный период телят лучше всего выводить в лагери.
Разрыв контакта между телятами и возбудителем диктиокаулеза достигается также содержанием молодняка в стойлах (с прилегающими к ним выгулами), без выпаса. Траву доставляют в помещения с лугов, свободных от личинок диктиокаулюсов; воду, при отсутствии водопровода, подвозят в бочках.
Ликвидации диктиокаулеза можно добиться путем поголовной и тщательной дегельминтизации в стойловый период всех гельминтоносителей; последних выявляют до выгона животных на пастбище, в период низких температур, не позволяющих развиваться личинкам. Дегельминтизации с интервалом в 10 - 15 дней повторяют при необходимости 2 - 3 раза, до полного освобождения телят от диктиокаулюсов.
Более трудоемкий и менее эффективный метод борьбы с этой инвазией представляют периодические в течение всего выпасного периода дегельминтизации с учетом сроков созревания гельминтов в организме хозяина.
Наилучших и быстрых результатов можно достигнуть одновременным применением первых трех вариантов - улучшения условий кормления и содержания, строгой изоляции телят текущего года рождения и поголовной дегельминтизации всех гельминтоносителей в стойловый период.
Если перечисленные мероприятия почему-либо не были своевременно осуществлены, рекомендуется следить за появлением первых признаков диктиокаулеза в стаде (а еще лучше за появлением первых личинок возбудителя в кале телят) и сразу же приступить к дегельминтизации и другим мерам. Если упустить этот момент, болезнь переходит в более тяжелую клиническую форму, и в таких случаях неизбежен отход животных. Борьба с диктиокауле-зом при развившейся тяжелой клинике болезни исключительно трудна и менее действенна.
Добившись тем или иным путем ликвидации диктиокаулеза в хозяйстве, принимают меры против нового занесения его с приобретаемыми для пополнения стада телятами. С этой целью весь поступающий в хозяйство скот обследуют в период карантинирования на диктиокаулез.
3.Роль отечественных ученых в развитии гельминтологии .
В развитии паразитологии важную роль сыграли труды западноевропейских ученых — Кюхенмейстера (G.F.H. Kuchenmeister), Фогта (K. Vogt), Лейкарта (R. Leuckart), Росса (R. Ross), Менсона (P. Manson), Даттона (J.E. Dutton), Теоболда (E.V. Theobald), Никола (J. Nicolas) и др.
Первая попытка характеристики животных паразитов и точной формулировки особенностей, отличающих их от свободноживущих организмов, принадлежит немецкому паразитологу, профессору зоологии университетов в Гессене, Лейпциге - Рудольфу Лейкарту. Им описано большое количество новых паразитов, изучена биология пятиусток и других гельминтов, предложена новая классификация беспозвоночных. По Лейкарту отличительныи признаком паразита является способ питания: «каждый организм, питающийся за счет другого живого организма, не убивая его, как это делает хищник, тем самым является паразитом».
Значительный вклад в развитие паразитологии на этом этапе был внесен и советскими учеными. А.П. Федченко изучил цикл развития ришты и составил перечень паразитических червей человека и животных, распространенных в Средней Азии. И.А. Порчинским были опубликованы сводные работы о слепнях, комарах, оводах и мухах, Ю.Н. Вагнером — о блохах, Н.А. Холодковским — о вшах, В.В. Фавром и Н.М. Кулагиным — о комарах. В.Л. Яковлев составил первую сводку о клещах России. Н.А. Холодковский создал первый в России «Атлас человеческих глист» и выполнил серию работ по систематике ленточных червей. И.И. Мечников высказал гипотезу о том, что клещи служат переносчиками возбудителей спирохетозов. Одним из основоположников протозоологии был Л.С. Ценковский (1822 - 1887), известный своими работами по изучению инфузорий и других простейших. Исследования паразитов крови животных, проведенные В.Я. Данилевским (1852 - 1939), послужили одним из доказательств патогенности возбудителей малярии и роли комаров в их передаче. Крупный гематолог и маляриолог Д.Л. Романовский (1861 - 1921) предложил метод окраски препаратов крови, ставший ныне общепринятым.
В 20-х годах прошлого века в процессе борьбы с широко распространившимися тогда эпидемиями сыпного тифа, малярии и других паразитарных и трансмиссивных болезней в нашей стране началось бурное развитие медицинской паразитологии. Ее основоположниками были выдающиеся ученые, труды которых получили мировую известность.
Е.И. Марциновский (1874 - 1934) в 1924 г. создал и возглавил первое в СССР крупное научное учреждение паразитологического профиля — Институт протозойных заболеваний и химиотерапии (Тропический институт) — ныне Институт медицинской паразитологии и тропической медицины им. Е.И. Марциновского, Московской медицинской академии им. И.М. Сеченова. Перед коллективом института была поставлена задача ликвидировать малярию как массовое заболевание на территории нашей страны, которая была успешно решена к 1960 г.
К.И. Скрябин (1878 - 1972) основал отечественную гельминтологию, которая как по своим научным достижениям, так и по их практической реализации значительно превзошла уровень, достигнутый в то время в области гельминтологии в зарубежных странах, благодаря чему было резко сокращено распространение в нашей стране многих гельминтозов.
В.А. Догель (1882 - 1955), В.Я. Беклемишев (1890 - 1962) и Е.Н. Павловский (1884 - 1965) заложили основы экологической паразитологии. Развитие ее привело к возникновению популяционной паразитологии, в которой взаимоотношения паразита и хозяина рассматриваются на уровне популяций. Большим вкладом в развитие экологической паразитологии явились предложенные Е.Н. Павловским концепция об организме хозяина как среде обитания паразитов и теория паразитоценозов.
Е.Н. Павловский и сотрудники его школы, пользуясь разработанным ими методом экспедиционных исследований, в короткое время добились значительных успехов в изучении членистоногих — переносчиков возбудителей трансмиссивных болезней на больших территориях, особенно в отдаленных окраинных районах страны. Была установлена роль различных групп членистоногих в распространении возбудителей ряда трансмиссивных болезней, в том числе и ранее неизвестных (клещевой, или весенне-летний, энцефалит, клещевой сыпной тиф Северной Азии и др.). В ходе этих работ по изучению переносчиков, их хозяев и путей циркуляции возбудителей трансмиссивных болезней в природе Е.Н. Павловским было сформулировано учение о природной очаговости болезней, которое положило начало развитию эколого-географического направления в паразитологии и смежных наук (ландшафтная эпидемиология, медицинская география и др.). Были разработаны и эффективно осуществлялись меры профилактики ряда трансмиссивных и природноочаговых болезней.

Е.Н. Павловский, начальник кафедры биологии и медицинской паразитологии Военно-медицинской академии (1921 - 1956)
В 1918 году по инициативе профессоров Н.А. Холодковского и Е.Н. Павловского в стенах Военно-медицинской академии впервые в России было организовано преподавание новой для того времени дисциплины — медицинской паразитологии.
Б.П. Савицкий, Л. С. Цвирко изучали проблемы природноочаговых зоонозов и их профилактики на особо охраняемых природных территориях Белорусского Полесья.
Е.И.Бычкова и ее ученики, проведя исследования на территории Национального парка «Нарочанский» в ряду заповедная зона - зона регулируемого пользования - зона хозяйственного пользования, дали оценку структуры сообществ паразитов и хозяев и основные закономерности ее динамики на охраняемых природных территориях.
4.Эпизоотическая ситуация в отношении инвазионных заболеваний (по данным исследований) всех видов животных в обслуживаемом хозяйстве (или зоне).Мероприятия ,проводимые по борьбе с ними.
Эпизоотическкая ситуация по анаплазмозу крупного рогатого скота в Кильмезском районе.
Анаплазмоз жвачных животных – трансмиссивная кровепаразитарная болезнь крупного и мелкого рогатого скота вызываемая кровепаразитами из рода анаплазм, протекающая с симптомами общего угнетения, анемии, атонии желудочно кишечного тракта, лихорадкой непостоянного типа и истощением. Из домашних животных анаплазмозом болеют крупный рогатый скот, буйволы, зебу, овцы, козы. Из диких животных анаплазмозом болеют некоторые виды антилоп, олени, лоси, сайгаки, козероги, архары, лани, гну, полевые мыши и другие грызуны. Обычно анаплазмоз регистрируется в местах распространения пироплазмоза, бабезиоза, тейлериоза, нередко в виде смешанной инвазии.
Возбудитель анаплазмоза крупного рогатого скота – Anaplasma marginale, у мелкого рогатого скота – Anaplasma ovis. Возбудитель. По своим морфологическим признакам анаплазмы близки к риккетсиям. Анаплазмы имеют одноконтурную плазматическую мембрану, клеточную стенку, нуклеоид, тяжи, фибриллы и мембранные структуры в цитоплазме. Возбудители анаплазмоза локализуются в эритроцитах, иногда анаплазм находят в лейкоцитах и тромбоцитах, где они формируют колонии, состоящие из 2-8 особей. При микроскопии мазков крови окрашенных по Романовскому анаплазмы имеют вид фиолетово-синеватых или рубиновых округлых включений величиной 0,1-1,25µ, реже встречаются анаплазмы угловатой или вытянутой форме с отростками (последние бледнее окрашены). Принято считать, что анаплазмы располагаются ближе к краю эритроцита. В эритроците встречаются по 1-2 и реже 3-4 паразита, иногда больше
Рисунок1. Анаплазмы в эритроцитах.
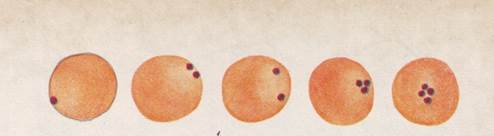
Цикл развития. Размножаются анаплазмы в эритроцитах методом простого деления или почкования, в результате чего образуют колонии. При электронной микроскопии в анаплазмах выявлены так называемые инициальные тельца, которые состоят из микроколоний. Поражение здоровых эритроцитов при анаплазмозе происходит в результате проникновения в них инициальных телец. Биологическими переносчиками анаплазм у животных являются 11 видов иксодовых клещей и один вид аргасовых (Alveonasus lahorensis). Во время кровососания больных анаплазмозом животных анаплазмы попадают в кишечник клещей, где размножаются. Передача возбудителей клещами происходит трансовариально и трансфазно. Механическими переносчиками анаплазм являются кровососущие насекомые. У овец перезаражение анаплазмозом может быть при паразитировании кошарного клеща, овечьей кровососки, кровососущих двухкрылых насекомых – мух, слепней, комаров и др. При несоблюдении существующих правил асептики и антисептики ветеринарные специалисты во время ветеринарных обработок (взятие крови, вакцинация, обрезка рогов и т.д.) с нестерильными инструментами могут переносить анаплазмоз от одного животного другому.
Экономический ущерб .Анаплазмоз крупного рогатого скота наносит большой ущерб животноводству. Он резко снижают продуктивность животных. уменьшается молокоотделение. При анаплазмозе падеж крупного рогатого скота может достигать 40%, обостряется течение некоторых инфекционных хронических болезней (анаплазмоз + инфекционная анемия). Так, же анаплазмоз отрицательно влияет на репродуктивную способность и резистентность организма животных. У переболевших животных (до 80%) в течение длительного времени наблюдаются сердечная недостаточность, нарушения деятельности других органов, низкая продуктивность и работоспособность.
Эпизоотологические данные. восприимчивы также лоси, северные олени, овцы, козы и буйволы. Болеют как взрослые животные, так и молодняк. Наличие восприимчивых животных в дикой фауне, клещей-переносчиков и широкое паразитоносительство позволяют отнести анаплазмоз к природно-очаговым болезням. Возбудителей анаплазмоза переносят иксодовые клещи 11 видов и один вид аргасовых, а также слепни, комары, мошки, мокрецы, мухи-жигалки и др. Передача анаплазм происходит трансфазно и трансовариально. Кровососущие насекомые могут переносить анаплазм от одних животных к другим в процессе питания кровью, однако в их организме они не размножаются, поэтому насекомых считают механическими переносчиками.
Анаплазмоз регистрируют весной, летом и осенью, р редких случаях болезнь встречается в зимнее время, особенно при плохом кормлении, в условиях минеральной и витаминной недостаточности.
В Кировской области бабезиоз КРС впервые был зарегистрирован в 2006 г. в Верхошижемском районе в ОАО «Агрофирма Среднеивкино». Заболели три коровы с летальным исходом. В 2008 г. в Советском районе (СПК СА«Мушинский») заболели 5 коров, из них три животныхс летальным исходом, а в 2009 г. в ОАО «Мокинское»выявлено три случая бабезиоза. В 2010 г. число заболевших бабезиозом животных в Советском районе выросло в 3 раза (в СХПК «Лошкаринский» заболело 6 голов, в частном секторе д. Кочки — 3 коровы), а в 2012 г. — в 1,3 раза по сравнению с 2010 г. (заболело с летальным исходом 12 коров в Кирово-Чепецком районе (ООО «Аг-рофирма «Фатеево») и в Богородском районе (колхоз«Чирковский») Кировской области) . В 2013 г. бабезиоз был обнаружен в Верхошижемском районе в СХПК «Звезда» у двух коров, одна из которых, принадлежала частным владельцам, но выпасалась вместе со стадом хозяйства. Оба случая с летальным исходом .При микроскопии мазков из крови КРС в эритроцитах были обнаружены преимущественно парной грушевидной формы паразиты, соединенные тонкими концами под острым углом, что является характерным диагностическим признаком паразита Bаbеsiа bigemina (Рiroplasma bigeminum). Длина парных грушевидных форм была больше радиуса эритроцита, расположение в эритроците — в центре (рис. 1). Число паразитов в одном эритроците от одного до четырех. Размер парных грушевидных 2...3 мкм. Анаплазмоз КРС регистрируется в Кировской области 2005 г. В ходе исследований в категорию стационарно неблагополучных по анаплазмозу были отнесены три южных района области — Вятско-Полянский, Малмыжский, Кильмезский. Средний процент зараженности составил 80,56 %
Патогенез. . Попадая в организм восприимчивых животных, анаплазмы вызывают нарушение окислительно-восстановительных и обменных процессов. Для своего развития они используют фосфолипиды эритроцитов, уменьшение содержания фосфолипидов приводит к осмотической хрупкости последних. Сокращается продолжительность жизни эритроцитов, усиливается эритрофагоцитоз. В активности последнего важную роль играют аутоантитела, образующиеся против антигенно-измененных эритроцитов. Нарушается гемопоэз. Уменьшается содержание эритроцитов и гемоглобина в крови, что приводит к нарушению кислородного питания клеток и тканей. Развивается анемия. Гемоглобинурия бывает редко. В крови снижается содержание общего белка и альбуминов. После пика паразитемии ускоряется разрушение эритроцитов и прогрессирует анемия. В кровь поступает много незрелых и измененных эритроцитов (анизо- и пойкилоцитоз, ретикулоцитоз, эритробластоз). Нарушение обмена веществ ведет к интоксикации организма, воспалительным процессам, кровоизлияниям в органах и тканях. Развиваются сердечно-сосудистый и желудочно-кишечный синдромы.
Клинические признаки. Клиническая картина. Инкубационный период при естественном заражении от 3до 6 недель, реже до 3 месяцев. Болезнь может протекать остро и хронически.
Острое течение болезни у животного начинается с повышения температуры тела до 41°С и больше. Лихорадка имеет непостоянный тип. У животного ухудшается общее состояние, понижается аппетит. Появляется основной признак анаплазмоза – резко выраженная анемия. При исследовании крови отмечаем уменьшение содержания гемоглобина в 4-5раз, количества эритроцитов доходит до1млн. в 1мм³, уменьшается и показатель гематокрита. В крови отмечаем анизоцитоз, пойкилоцитоз, наличие ядерных эритроцитов и их базофильную зернистость. В начале болезни у больного животного находим лейкоцитоз, переходящий в лейкопению, при выздоровлении животного отмечаем лимфоцитоз. В сыворотке крови снижается содержание витамина. В результате нарушения минерального обмена, больные животные лижут или грызут стены, землю. Видимые слизистые оболочки бледные, могут быть желтушными. Поверхностные лимфатические узлы при пальпации увеличенные. Деятельность сердечно – сосудистой и дыхательной систем, в связи с развившейся у животного анемией, нарушается. В области шеи, подгрудка и живота могут появиться отеки. У больного животного развивается атония преджелудков, у коров снижаются удои. Больные животные резко худеют и слабеют, больше лежат. В моче находим много индикана, иногда ацетоновые тела. Количество эритроцитов иногда снижается до 1млн. в 1 мм³. Во второй половине беременности у животных наступает аборт. Острое течение болезни длится 15- 30 суток. При выздоровлении животного имеющиеся признаки болезни постепенно исчезают, однако упитанность животного восстанавливается медленно.
Хроническое течение анаплазмоза у животного сопровождается перемежающей лихорадкой. Такие животные плохо принимают корм, при перегонах быстро устают, не набирают массу тела даже при хорошем кормлении. При клиническом осмотре отмечаем атонию и гипотонию преджелудков. При исследовании крови регистрируем уменьшение числа эритроцитов, снижается содержание гемоглобина. В результате чего видимые слизистые оболочки бледные. Отмечаем базофильную зернистость, что для ветеринарного специалиста является благоприятным прогностическим признаком и больное животное постепенно выздоравливает.
Диагноз. Диагноз на анаплазмоз ставят на основании эпизоотического состояния местности, сезона года, клинических признаков болезни и результатов микроскопического исследования мазков крови по Романовскому на наличие анаплазм. Разработаны серологические методы диагностики (РА,РСК,РИФ). Больные и недавно переболевшие животные дают положительную реакцию в титрах от 1:80 до 1:280 и выше, у паразитоносителей – от 1:10 до 1:40. Диагноз считается установленным, если будут обнаружены анаплазмы в мазках крови.
Микроскопически диагноз ставят на основании обнаружения паразитов в мазках крови от больного и подозрительного по заболеванию животного.
Мазки фиксируют метиловым спиртом (3 - 5 минут) или этиловым (20 - 25 минут), или смесью этилового спирта и серного эфира в равных количествах (10 - 15 минут). После высушивания мазки окрашивают по методу Романовского (краска Гимза 1 - 2 капли на 1 мл воды, лучше слабощелочной или нейтральной реакции), азур-эозином или ускоренным способом по Анаплазмы окрашиваются в темно-красный цвет, имеют округлую форму (похожи на точки), расположены преимущественно по периферии эритроцита. Размеры паразитов от 0,2 до 1,2 мк.
Степень пораженности эритроцитов бывает различной - от незначительной до 50% и более зараженных эритроцитов. В отличие от телец Жолли анаплазмы обычно мельче и менее интенсивно окрашены.
Реакция иммунофлюоресценции — РИФ (метод Кунса)
Различают три основные разновидности метода:
1. прямой,
2. непрямой
3. с комплементом.
Реакция Кунса является методом экспресс-диагностики для выявления антигенов микробов или определения антител.
Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа.
Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета.
Непрямой метод РИФ заключается в выявлении комплекса антиген—антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела +антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе.
Реакция связывания комплемента (РСК) заключается в том, что при соответствии друг другу антигены и антитела образуют иммунный комплекс, к которому через Fc-фрагмент антител присоединяется комплемент (С), т. е. происходит связывание комплемента комплексом антиген—антитело.
Если же комплекс антиген—антитело не образуется, то комплемент остается свободным.
РСК проводят в две фазы:
1-я фаза — инкубация смеси, содержащей три компонента антиген + антитело + комплемент;
2-я фаза (индикаторная) — выявление в смеси свободного комплемента путем добавления к ней гемолитической системы, состоящей из эритроцитов барана, и гемолитической сыворотки, содержащей антитела к ним. В 1-й фазе реакции при образовании комплекса антиген—антитело происходит связывание им комплемента, и тогда во 2-й фазе гемолиз сенсибилизированных антителами эритроцитов не произойдет; реакция положительная. Если антиген и антитело не соответствуют друг другу (в исследуемом образце нет антигена или антитела), комплемент остается свободным и во 2-й фазе присоединится к комплексу эритроцит — антиэритроцитарное антитело, вызывая гемолиз; реакция отрицательная.
Дифференциальный диагноз. Анаплазмоз необходимо дифференцировать от пироплазмоза, тейлериоза, бабезиоза, лептоспироза и сибирской язвы.
Лечение. Больных животных оставляют в помещениях, назначают диетические корма. Применяют симптоматическое лечение в зависимости от показаний.
При анаплазмозе в качестве специфического препаратов используются антибиотики тетрациклинового ряда - такие как тетрациклин, хлортетрациклин (биомицин), окситетрациклин (террамицин) и антибиотики нового поколения (окситетра-200, оксигель, тетрадур).
Профилактика и меры борьбы . Для успешной профилактики анаплазмоза необходимо сочетание общих ветеринарно-санитарных мероприятий и специфических противо-анаплазмозных мер.
Профилактические мероприятия в неблагополучных хозяйствах
Диспансеризация поголовья проводится двукратно: перед выгоном на пастбище и после постановки животных в стойла. У всех животных хозяйства исследуют кровь в РДСК на анаплазмоз, проводят микроскопию мазков крови. Больных животных изолируют и лечат, с последующим выпасанием их на изолированных пастбищах пожизненно.
Приплод от больных коров должен обследоваться на анаплазмоз в течение первых двух-трех месяцев жизни, ввиду возможности трансплацентарного заражения. Целесообразно выделение для них отдельной фермы. По возможности эти животные, как резервуар возбудителя, должны выбраковываться. Все остальные животные обрабатываются инсектоакарицидными препаратами непосредственно перед выгоном на пастбище и после постановки в стойла, а при высокой заклещеванности и дополнительно. После постановки животных в стойла проводится вакцинация всего здорового поголовья инактивированной эмульгированной вакциной в дозе 0, 5 -3 мл п/к, двукратно, с интервалом между введениями 45 сут. Продолжительность иммунитета 12 мес. Следует максимально ограничить вывоз животных из хозяйства. Все вывозимые животные должны в обязательном порядке обследоваться на анаплазмоносительство серологически и микроскопией мазков крови








