10. Rb2O2 + RbMnO4 + … → … + … + Rb2SO4 + H2О
Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель:
1. K2Cr2O7 + H2S + … → Cr2(SO4)3 + S + … + H2O
2. H2S + … + H2SO4 → S+ Cr2(SO4)3 + … + …
3. Cl2 + … = NaClO3 + … + H2O
4. Si + …… + HF → SiF4 + NO + ……
5. CrCl3 + H2O2 + … = Na2CrO4 + … + H2O
6. HI + H2SO4 → … + H2S + …
7. H2O2 + KMnO4 + ... → … + MnSO4 + ... + H2O
8. H2O2 + … + H2SO4 → O2 + … + MnSO4 + H2O.
9. КМnО4 + Н2О2 + ….. → МnSО4 + О2 +……. +……..
10. Rb2O2 + RbMnO4 + … → … + … + Rb2SO4 + H2О
11. KMnO4 + SnSO4 + … = MnSO4 + Sn(SO4)2 + …. + H2O
12. PH3 + KMnO4 + … → … + MnSO4 + … + H2O
13. CrCl3 + H2O2 + … → K2CrO4 + … + …
14. KI+K2MnO4+…→…+ MnO2+…
15. Cr2O3 + Br2 + NaOH → Na2CrO4 + … . + ….
16. HClO3 + … + FeSO4 → Fe2(SO4)3 + … + …
17. N2O + … H2SO4 → NO + … . + MnSO4 + …
18. Fe2O3 + KNO3 + KOH = … + KNO2 + …
19. Fe2O3 + KNO3 + … → K2FeO4 + … + …
20. MnO2 + KClO3 + K2CO3 = … + … + CO2
21. … + CrO3 + H2SO4 → Fe2(SO4)3 + … + H2O
22. Na2O2 + … + H2SO4 → I2 + … + K2SO4 + …
23. Na2O2 + KI + … ® … + K2SO4 + Na2SO4 + …
24. CS2 + KMnO4 + …. = S + MnO2 + …. + ….
25. H2S + KMnO4 + … → K2SO4 + 5S + … + …
26. FeCl2 + KClO4 + HCl → … + Cl2 + … + …
27. NaOCl + KI + … = NaCl + … + K2SO4 + ….
28. FeSO4 + KMnO4 + ….. = Fe2(SO4)3 + ….. + K2SO4 + …..
29. Cu + KNO3 +… → … + K2SO4 +NO + H2O
30. K2Cr2O7 + Al + …..→ CrSO4 + Al2(SO4)3 + ….. + …..
31. Zn + Na2SO3 + …→ ZnCl2 + H2S + …+ …
32. SnCl2 + … + K2Cr2O7 = H2[SnCl6] + CrCl3 + … + …
33. FeCl2 + HNO2 + … = … +N2 + Fe2(SO4 )3 +…
34. K3[Cr(OH)6] + … + KOH → …. + KBr + H2O
35. MnO2 + NaBiO3 + …. → ….+ BiONO3 + NaNO3 + H2O
36. KNO3 + FeCl2 + … → NO + FeCl3 +… + …
37. MnO2 + … + 2H2SO4 конц= К2SO4+ …+… + Br2
38. NaNO2 + … + H2SO4 → … + Cr2(SO4)3 + … + …
39. Na2SO3 + ... + K2Cr2O7 = Na2SO4 + ... + ... + ...
40. KNO3 + … + Cr2O3 → K2CrO4 + KNO2 + …
41. K2Cr2 O7 + … = Cl2 + CrCl3 + … + …
42. Br2 + MnSO4 + … ® MnO2¯ + NaBr + … + …
43. KI + H2SO4(конц) = … + H2S + ... + H2O
44. Zn + KClO3 + … + H2O = K2[Zn(OH)4] + …
45. SnCl2 + K2Cr2O7 + HCl → SnCl4 + … + … + …
46. PbO2 + Mn(NO3)2 + … = … + Pb(NO3)2 + H2O
47. Cr2(SO4)3 + KClO3 + … → Na2CrO4 + KCl + … + …
48. Cu2O + …… + 2KMnO4 = CuSO4 + MnSO4 + ….. + …..
49. P + CuSO4 + … = … + Cu + H2SO4
РЕШЕНИЯ
1. K2Cr2O7 + 3H2S + 4H2SO4 → Cr2(SO4)3 + 3S + K2SO4 + 7H2O
2Cr+6 + 6ē → 2Cr+3 1 восстановление
S-2 – 2ē → S0 3 окисление
K2Cr2O7 – окислитель за счет Cr+6
H2S – восстановитель за счет S-2
3. 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O
Cl20 – 10е ® 2Cl+5 1 окисление
Cl20+ 2е ® 2Cl-1 5 восстановление
Cl2 – окислитель и восстановитель
4. 3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Si0 – 4e → Si+4 1 окисление
N+5 + 1е ® N+4 4 восстановление
Si0 – восстановитель
HNO3 – окислитель за счет N+5
5. 2Cr+3 Cl3 + 3 H2O21- + 10 NaOH = 2 Na2Cr+6O4 + 6 NaCl + 8 H2O-2
Cr+3 - 3ē → Cr+6 2 окисление
O21- + 2ē → 2O-2 3 восстановление
CrСl3 (Cr+3) – восстановитель,
H2O2 (O-1) – окислитель
6. 8HI + H2SO4 → 4I2 + H2S + 4H2O
S+6 + 8 е = S-2 1 окисление
2I-1 - 2 е = I02 4 восстановление
HI – восстановитель за счет I-1 H2SO4 – окислитель за счет S+6
7. 5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2 SO4 +8H2O
Mn+7 + 5e → Mn+2 2 восстановление
2O -1 – 2e → O2 0 5 окисление
KMnO4 – окислитель за счет Mn+7
H2O2 – восстановитель за счет O -1
10. 5 Rb2O-12 + 2RbMn+7O4 + 8H2SO4 → 5O02 + 2Mn+2SO4 + 6Rb2SO4 + 8H2O
2O-1 -2e→ O02 5 окисление
Mn+7 +5e→Mn+2 2 восстановление
Rb2O2 – восстановитель за счет O-1
RbMnO4 – окислитель за счет Mn+7
11. 2KMn+7 O4 + 5Sn+2SO4 + 8Н2SO4 = 2Mn+2SO4 + 5Sn+4(SO4)2 + К2SO4 + 8H2O
Mn+7 +5е → Mn+2 2 восстановление
Sn+2 - 2е → Sn+4 5 окисление
KMnO4 – окислитель за счет Mn+7
SnSO4 – восстановитель за счет Sn+2
12. 5P-3H3 + 8KMn+7O4 + 12H2SO4 → 5H3P+5O4 + 8Mn+2SO4 + 4K2SO4 + 12H2O
P- 3 – 8 е ® P+5 5 окисление
Mn+7+ 5 е ® Mn+2 8 восстановление
PH3 – восстановитель за счет P-3
KMnO4 – окислитель за счет Mn+7
13. 2Cr+3Cl3 + 3H2O-12 + 10KOH → 2K2Cr+6O4 + 6KCl + 8H2O-2
Cr+3 – 3е → Cr+6 2 окисление
2O-1 + 2е → 2O-2 3 восстановление
Cr+3 в составе CrCl3 – восстановитель
O-1 в составе H2O2 – окислитель
14. 2KI + K2MnO4 + 2H2O→ I2+ MnO2+ 4KOH
2I– – 2 е ® I20 1 окисление
Mn+6+ 2 е ® Mn+4 1 восстановление
KI – восстановитель за счет I2
K2MnO4 – окислитель за счет Mn+6
15. Cr+32O-23 + Br2 + 10NaOH = 2Na+12Cr+6O4 + 6NaBr-1 + 5H2O
Cr+3 -3e → Cr+6 2 окисление
Br02 +2e →2Br-1 3 восстановление
Cr2O3 – восстановитель за счет Cr+3
Br02 – окислитель
16. HClO3 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + HCl + 3H2O
Cl+5 + 6e → Cl-1 1 восстановление
2Fe+2 – 2e → 2Fe+3 3 окисление
HClO3 – окислитель за счет Cl+5
FeSO4 – восстановитель за счет Fe+2
17. 5 N2O + 3 H2SO4 + 2 KMnO4 = 10 NO + 2 MnSO4 + K2SO4 +3H2O
2N+1 – 2e = 2N+2 5 окисление
Mn+7 + 5e = Mn+2 2 восстановление
KMnO4 – окислитель за счет Mn+7
N2O – восстановитель за счет N+1
18. Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O
N+5 +2e 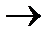 N+3 3 восстановление
N+3 3 восстановление
2Fe+3-6e 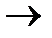 2Fe+6 1 окисление
2Fe+6 1 окисление
Fe2O3 – восстановитель за счёт Fe+3
KNO3 – окислитель за счёт N+5
20. 3MnO2 + KClO3 + 3K2CO3 = 3K2MnO2 + KCl + 3CO2
Mn+4 – 2e → Mn+6 3 окисление
Cl+5 +6e →Cl-1 1 восстановление
KClO3 – окислитель за счет Cl+5
MnO2 – восстановитель за счет Mn+4
21. 6FeSO4 + 2CrO3 + 6H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + 6H2O
Cr+6 + 3e → Cr+3 1 восстановление
Fe+2 - 1e → Fe+3 3 окисление
CrO3 – окислитель за счет Cr+6
FeSO4 – восстановитель за счет Fe+2
22. Na2O2-1 + 2KI-1 + 2H2SO4 = I20 + Na2SO4 + K2SO4 + 2H2O-2
O-1 + 1e→O-2 2 восстановление
2I-1 – 2e→ 2I0 1 окисление
Na2O2 окислитель за счет O-1
KI – восстановитель за счет I-1
24. 3CS2 + 4KMnO4 + 2KOH = 6S + 4MnO2 +3K2CO3 + H2O
2S-– 2 – 4 е ® 2S0 3 окисление
Mn+7+ 3 е ® Mn+4 4 восстановление
CS2 – восстановитель за счет S-– 2
KMnO4 – окислитель за счет Mn+7
25. 5H2S-2 + 2KMn+7O4+ 3H2SO4 → K2SO4 + 5S0 + 2MnSO4 + 8H2O
S-2 -2e → S0 5 окисление
Mn+7 +5e → Mn+2 2 восстановление
H2S – восстановитель за счет S-– 2
KMnO4 – окислитель за счет Mn+7
26. 14FeCl2 + 2KClO4 + 16HCl → 14FeCl3 + Cl2 + 2KCl + 8H2O
Fe+2 – 1е → Fe+3 14 окисление
2Cl+7 + 14е → Cl20 1 восстановление
FeCl2 – восстановитель за счет Fe+2
KClO4 – окислитель за счет Cl+7
27. NaOCl + 2 KI + H2SO4 = NaCl + I2 + K2SO4 + H2O
Cl+1 + 2e → Cl-1 1 восстановление
2I-1 – 2e → I2 1 окисление
NaOCl – окислитель за счет Cl+1
KI – восстановитель за счет I-1
28. 10Fe+2SO4 + 2KMn+7O4 + 8H2SO4 = 5Fe2+3 (SO4)3 + 2Mn+2SO4 + K2SO4 + 8H2O
2Fe+2 – 2e = 2Fe+3 5 окисление
Mn+7 + 5e = Mn+2 2 восстановление
Fe SO4 – восстановитель за счет Fe+2
KMnO4 – окислитель за счет Mn+7
29. 3Cu0 + 2KN+5O3 +4H2SO4 → 3CuSO4 + K2SO4 + 2N+2O + 4H2O
Cu0─ 2e → Cu+2 3 окисление
N+5 +3e → N+2 2 восстановление
Cu0 – восстановитель
KN+5O3 – окислитель за счет N+5
30. 3K2Cr2+6O7 + 8Al0 + 21H2SO4 → 6Cr+2SO4 + 4Al2+3(SO4)3 + 3K2SO4 + 21H2O








