Опыт 4. Получение основной соли
Цель опыта
Получить гидроксосульфат меди (II) и провести реакции с кислотой и щелочью.
Ход опыта
· В две пробирки налейте 0,5–1,0 мл раствора сульфата меди (II).
· В одну пробирку добавьте раствор гидроксида натрия (щелочи) до образования обильного осадка – гидроксида меди (II).
· В другую пробирку добавьте несколько капель раствора гидроксида натрия до появления помутнения – осадка основной соли, гидроксосульфата меди (II).
· Через 3 минуты отметьте цвета осадков гидроксида и основной соли меди (II).
· Разделите осадок основной соли в две пробирки, а затем в одну из них добавьте 1 мл раствора серной кислоты, в другую – 1 мл раствора гидроксида натрия (щелочи).
Результаты и наблюдения
· Цвета осадков:
гидроксида меди (II) – ________________________________________________ ;
основной соли меди – ________________________________________________ .
· Осадок основной соли ____________________________________ в кислоте и
(растворяется или не растворяется)
___________________________________ в щелочи.
(растворяется или не растворяется)
· При взаимодействии со щелочью цвет осадка меняется на _______________ .
Обработка результатов
· Молекулярное и ионное уравнения реакции образования гидроксида меди (II) (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________________________________________________________
· Молекулярное и ионное уравнения реакции образования гидроксосульфата меди (II) (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________________________________________________________
· Молекулярное и ионное уравнения реакции взаимодействия гидроксосульфата меди (II) с серной кислотой (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________________________________________________________
· Молекулярное и ионное уравнения реакции взаимодействия гидроксосульфата меди (II) с гидроксидом натрия (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы
· Один из способов получения основных солей – взаимодействие
____________________________________________________________________
· Основные соли можно перевести в средние действием ___________________
· Основные соли взаимодействуют со щелочами, при этом образуются
____________________________________________________________________
· Основные соли ____________________________________________________
(растворимы или нерастворимы в воде)
Лабораторная работа 5
Условия образования и растворения осадков. Произведение растворимости
Сравнительная растворимость в воде сульфата и карбоната кальция
Цель опыта
· Сравнить растворимость сульфата и карбоната кальция.
Ход опыта
· Налейте в пробирку 1–2 мл раствора хлорида кальция.
· Добавьте 2–3 мл раствора сульфата натрия.
· Через 5–10 мин перенесите прозрачную часть раствора в другую пробирку.
· Убедитесь в полноте осаждения сульфата кальция, для этого к полученному раствору добавьте одну каплю раствора сульфата натрия – осадок не должен образовываться.
· В прозрачный раствор добавьте несколько капель карбоната натрия до образования осадка.
Результаты и наблюдения
· При взаимодействии хлорида кальция и сульфата натрия _________________
____________________________________________________________________
· При действии карбонатом натрия на полученный раствор ________________
____________________________________________________________________
ПР CaSO4 = 6,1 · 10 -5 ПР CaCO3 = 5 · 10 -9
Обработка результатов
· Молекулярное и ионное уравнения реакции получения сульфата кальция:
____________________________________________________________________________________________________________________________________________________________
· Отделенный от осадка раствор сульфата кальция является
____________________________________. Добавление к нему карбоната натрия
(ненасыщенным, насыщенным, пересыщенным)
приводит к образованию ______________________________ раствора карбоната
(ненасыщенного, насыщенного, пересыщенного)
кальция и образованию осадка.
· Молекулярное и ионное уравнения реакции получения карбоната кальция:
____________________________________________________________________________________________________________________________________________________________
· Значение константы равновесия (К) реакции:
CaSO4 + CO32- 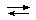 CaCO3 + SO42- (1)
CaCO3 + SO42- (1)
К= ——————————— = Ошибка! Ошибка связи. =
свидетельствует о том, что равновесие смещено в сторону ___________________________
(прямой, обратной)
реакции. Следовательно, в присутствии карбонат-ионов сульфат кальция
______________________ в карбонат кальция.
(переходит, не переходит)
Выводы
· Данные опыта свидетельствуют, что растворимость сульфата кальция
____________________ растворимости карбоната кальция.
(больше, меньше)
· Реакции обмена идут в направлении образования _______________________
__________(более, менее)
растворимых продуктов.
Лабораторная работа № 6
"Гидролиз солей"








