Уравнения состояния идеального газа, уравнение Клапейрона – Менделеева.
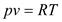 - для 1 кг газа;
- для 1 кг газа; 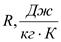
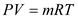 - для произвольного количества газа;
- для произвольного количества газа;
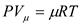 - для 1 кмоля;
- для 1 кмоля;
где 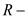 газовая характеристическая постоянная,
газовая характеристическая постоянная, 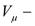 молярный объем;
молярный объем; 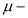 молярная масса;
молярная масса; 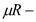 универсальная газовая постоянная;
универсальная газовая постоянная;
Уравнение Ван-дер-Ваальса: 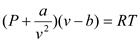 , где
, где 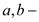 постоянная Ван-дер-Ваальса.
постоянная Ван-дер-Ваальса.
13.Теплоемкость
Теплоемкость материального тела равна количеству теплоты, которую нужно подвести к телу, чтобы нагреть его на 10. Удельная теплоемкость – теплоемкость единицы количества вещества.
В зависимости от того, в чем выражается количество, различают удельные теплоемкости:
1.массовую, 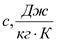
2.объемную, 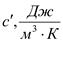
3.молярную, 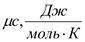
Величина теплоемкости зависит от условий нагрева или охлаждения:
изобарная теплоемкость 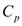 , изохорная теплоемкость
, изохорная теплоемкость 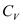 .
. 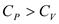 - для газов.
- для газов.
Уравнение Майера: 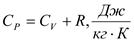
Физический смысл газовой постоянной: газовая постоянная равна работе, которую совершает 1 кг газа, при нагреве на 10 в изобарном процессе.
Различают истинную и среднюю теплоемкости:
Истинная теплоемкость определяется для бесконечно малого интервала температур: 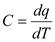 .
.
Средняя теплоемкость находится для конечного интервала температур: 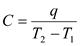 ;
; 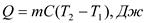
Теплоемкость сложной системы равна сумме теплоемкостей компонентов.
14. Понятие термодинамического процесса. Равновесный и неравновесный, обратимый и необратимый процессы
Термодинамический процесс - процесс перехода термодинамической системы из одного состояния в другое.
Разновесным называется процесс, когда значения одноименных параметров во всех точках системы одинаковы в любой фиксированный момент времени. В природе равновесных процессов не существует.
Термодинамический процесс:
1
p
2
v
1-2 – график термодинамического процесса; 2-1 – обратный процесс.
Обратным называется термодинамический процесс, когда в прямом и обратном направлении система проходит через одинаковые состояния в обратной последовательности.
После возвращения системы в исходное состояние в точку 1, окружающая среда так же вернется в исходное состояние, иначе процесс необратим. Реальные процессы необратимы.
15. Основные термодинамические процессы
• Изохорный процесс 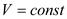
Р
Закон Шарля: 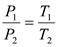
График изохорного процесса:
V
2.Изобарный процесс 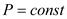
Закон Гей-Люссака: 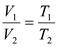
Р
V
3. Изотермический процесс 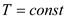
Закон Бойля-Мариотта: 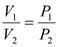
p теплоемкость 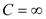
4. Адиабатный процесс – процесс идущий без теплообмена системы с окружающей средой, 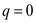
(расширение газа в двигателе).
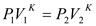 ;
; 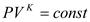
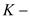 показатель адиабаты.
показатель адиабаты.
p 
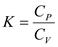
V
К=1,67 (для одноатомного идеального газа); К=1,4 (для 2-х атомного газа); К=1,29 (для трехатомного газа).
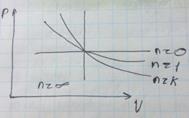
5.Политропный процесс
 ;
; 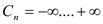 ;
; 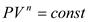 ;
; 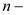 показатель адиабаты;
показатель адиабаты; 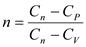
Значение показателей политропны в основных термодинамических процессах:
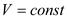
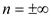
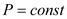
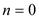
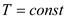
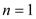
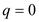
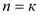
16. Внутренняя энергия и энтальпия- калорические параметры вещества
Внутренняя энергия существует внутри тела.
-внутренняя энергия.
Составляющие внутренней энергии:
• совокупность кинетической энергии микрочастиц.
• потенциальная энергия взаимодействия микрочастиц.
• энергия электронных оболочек атомов.
• внутриядерная энергия.








