Изучение химических свойств в логической связи со строением вещества
Тема урока: Основные виды химической связи. Ионная и Металлическая связь. Водородная связь.
Цель урока: сформировать понятие о химической связи и научить учащихся определять ее тип в различных соединениях по химической формуле вещества.
Задачи:
Образовательные:
сформировать представление учащихся о единой природе химической связи;
познакомить учащихся с различными типами химических связей;
научить школьников определять типы химических связей в различных соединениях.
Развивающие:
формировать умение определять тип химической связи в соединении;
развивать устную речь учащихся, умение применять знания в новой ситуации;
развитие творческого химического мышления.
Воспитательные:
развивать познавательный интерес учащихся;
способствовать росту инициативы и самостоятельности;
.Техническое обеспечение урока: компьютер
Изучение химических свойств в логической связи со строением вещества
Если не знаешь причинности и связей, невозможно сравнивать и сопоставлять. (Сосан)
Лекция.
. Какие виды химической связи известны?
. Известны ковалентная связь, ионная связь, металлическая связь, водородная связь.
Вопрос. Что такое химическая связь?
Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
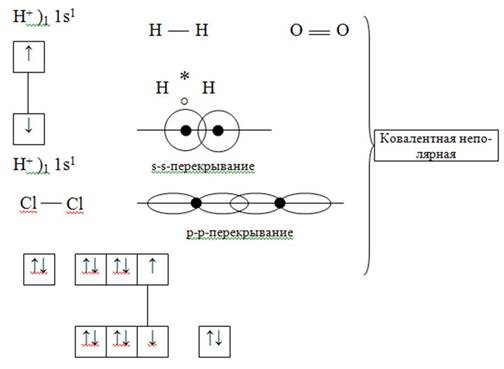
1. Ковалентная химическая связь – это связь, возникающая между атомами за счёт общих электронных пар.
- Что вы знаете о ковалентной химической связи?
Стремление к устойчивой электронной конфигурации за счёт образования общих электронных пар.
1) Обменный механизм
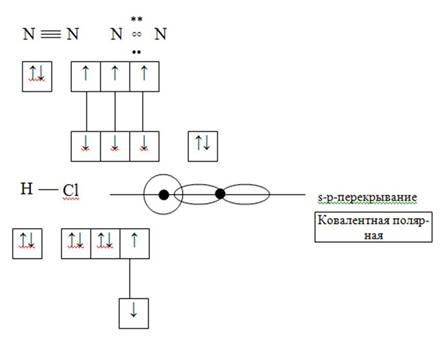
2) Донорно-акцепторный механизм
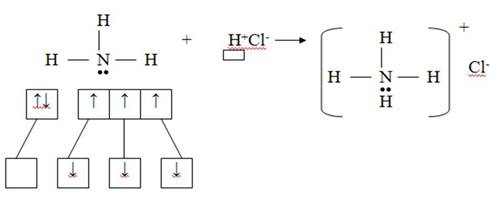
Азот – донор (имеет электронную пару), водород – акцептор (имеет свободную орбиталь)
По числу общих электронных пар (по кратности).
1) Одинарные.
2) Двойные.
3) Тройные.
По степени смещения.
1) Полярные.
2) Неполярные.
- Что такое электроотрицательность?
Электроотрицательность – это способность атомов химических элементов оттягивать на себя общие электронные пары, находящиеся в совместном владении
Неполярная – ковалентная химическая связь, образующаяся между атомами с одинаковой электроотрицательностью.
Полярная – ковалентная химическая связь, образующаяся между атомами с разной электроотрицательностью.
Молекула углекислого газа неполярная, так как имеет линейное строение
Кристаллическая решётка веществ с ковалентной химической связью: атомная и молекулярная. Атомная – очень прочная (графит, алмаз), молекулярная – газы, легколетучие жидкости, твёрдые легкоплавкие вещества (хлор, вода, йод, углекислый газ – «сухой лёд»). Молекулярная кристаллическая решётка непрочная, так как внутримолекулярные связи прочные, межмолекулярное взаимодействие слабое.
- Что вы знаете об ионной связи, ионной кристаллической решётке?
2. Ионная химическая связь – это химическая связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
Наиболее устойчивая электронная конфигурация атомов 8 электронов - 2s22p6 и 2 электрона - 1s2.
Me0 -nẽ ↔ Men+ (катионы)
неMe0 +nẽ ↔ неMen- (анионы)
Образуется ионная кристаллическая решётка
Физические свойства: твёрдые, прочные, тугоплавкие. 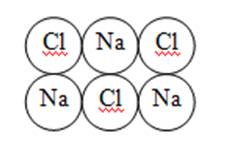
Растворы и расплавы ионных соединений – электролиты.
- Что такое электролиты?
- Определение электролитической диссоциации?
- Три случая образования электролитов?
Ионная связь – крайний случай ковалентной полярой связи, но в оличие от неё связь ненаправленная.
3. Металлическая связь – связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решётке.
Характеристика – ненаправленная, ненасыщенная, небольшое количество валентных электронов, большое количество свободных орбиталей.
Me0 -nẽ ↔ Men+
Физические свойства – твёрдость, тепло- и электропроводность, ковкость, пластичность, металлический блеск.
Металлическая кристаллическая решётка – в узлах ионы или атомы металлов, между которыми свободно перемещаются электроны.
4. Водородная химическая связь – это химическая связь между положительно поляризованными атомами водорода одной молекулы (или её части) и отрицательно поляризованными атомами сильноэлектроотрицательных элементов, имеющих неподелённые электронные пары (F, O, N, реже Cl и S) другой молекулы или другой её части.
Характер связи: частично электростатический, частично донорно-акцепторный.
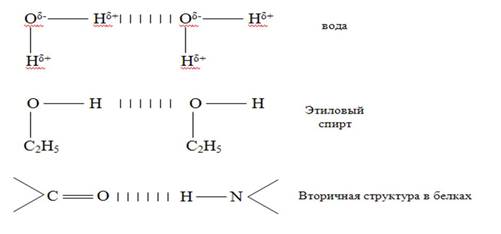
В молекулах ДНК цепи нуклеотидов связаны водородными связями в двойные спирали - принцип комплементарности (Ц-Г, А-Т).
Вещества с водородными связями имеют молекулярные кристаллические решётки.
Единая природа химической связи.
Ионная химическая связь – крайний случай ковалентной полярной химической связи. Металлическая связь совмещает в себе ковалентное взаимодействие атомов и электростатическое притяжение между ионами металлов и их электронами.
LiF – 80% ионной связи и 20% ковалентной полярной.
Основания: между кислородом и водородом в гидроксогруппе о ковалентная полярная связь, между металлом и гидроксогруппой – ионная.
Соли: в кислотном остатке – ковалентная полярная, между металлом и кислотным остатком – ионная.
.
Домашнее задание
1.Из предложенного перечня выберите два вещества, в которых присутствуют только ковалентные полярные связи.
1) КNO3
2) C (алмаз)
3) SiO2
4) HNO3
5) Na2S
Решение.
Ковалентная неполярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому только ковалентные полярные связи присутствуют в и .
Ответ: 34.
3. Из предложенного перечня выберите два вещества, в которых кислород образует ионные связи.
1) озон
2) оксид кальция
3) углекислый газ
4) оксид меди
5) вода
Запишите в поле ответа номера выбранных соединений.
Решение.
Оксид кальция и оксид меди это ионные соединения, потому что ионная связь образуется между атомами металлов и неметаллов.
Ответ: 24.
4. Из предложенного перечня выберите два вещества, для которых характерна водородная связь.
1) фенол
2) алкан
3) арен
4) спирт
5) алкин
Запишите в поле ответа номера выбранных соединений.
Решение.
Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (, и ), одной молекулы и атомом эле-мента с высокой электроотрицательностью (, , ) другой молекулы. Например, между атомом водорода одной молекулы фтороводорода и атомом фтора другой молекулы фтороводорода образуется водородная связь.
Среди предложенных веществ кислород в составе группы −ОН присутствует только в молекулах спиртов и фенолов, поэтому среди предложенных веществ водородная связь возможна между молекулами спиртов и фенолов. Остальные вещества относятся к углеводородам и не способны к образованию водородных связей








