Ионная связь образуется между типичным металлом и типичным неметаллом.
8 класс 05.05
Тема. Ковалентная связь. Ионная связь
Домашняя работа:
1) Посмотреть видео.
2) Записать конспект из файла (выучить);
3) задание в файле (письменно);
4) Повторить § 56
Ход урока.
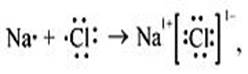
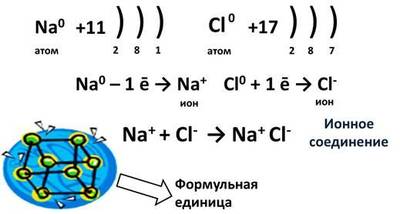 Рисунок – не рисовать!
Рисунок – не рисовать!
Ионная связь образуется между типичным металлом и типичным неметаллом.
Схема образования ионной связи между атомами кальция и хлора
Кальций расположен во IIA (А - главная подгруппа) группе, значит, на внешнем энергетическом уровне у него два электрона, которые легче отдать, чем присоединить шесть до завершения энергетического уровня. После чего он становится положительным ионом.
Са 0 - 2ē → Са 2+
Атому хлора, у которого на внешнем уровне 7 электронов, легче присоединить 1 электрон до завершения уровня, чем отдать 7 электронов. После присоединения 1 электрона, атом хлора становится отрицательным ионом.
Cl 0 + 1ē → Cl ⁻
Найдём наименьшее общее кратное между образовавшимися ионами. Оно равно двум.
Ca 0 + 2Cl 0 → Ca 2+ Cl2 ⁻
Цифра 2, стоящая перед атомом хлора, называется коэффициентом. Коэффициент обычно показывает число атомов, молекул или формульных единиц, а цифра 2 после иона хлора, называется индексом. Индекс показывает число атомов в молекуле или ионов в формульной единице.
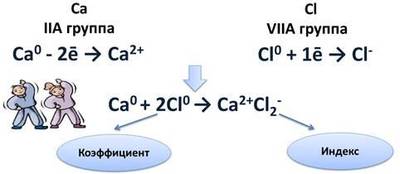
Химическая связь, которая возникает между ионами, называется ионной.
Определите тип химической связи в соединениях: (задание будет в Кр)
кнп – ковалентная неполярная связь
кп – ковалентная полярная связь
ис - ионная связь
Ме – металлическая связь
Образец оформления
Cl2 , HBr , CCl4 , BaF2 , O3 , F2 , KI , PCl5 , HF , S8 , Fе , K3PO4 (соль)
кнп кп кп ис кнп кнп ис кп кп кнп Ме ис
Самостоятельная работа (письменно)
Определите вид химической связи и тип кристаллической решетки в соединениях:
1 вариант 2 вариант
F2, K2S, HF, KI, NH3, I2, Zn FeCl2, Cl2, NO2, BaF2, CH4, N2, Al
«Типы кристаллических решеток»
(записать все, кроме физических свойств веществ)
| Тип решетки | Частицы в узлах решетки | Вид связи между частицами | Примеры веществ | Физические свойства веществ (не писать. прочитать) |
| Ионная | Ионы | Ионная | Соли, щелочи, некоторые оксиды K3PO4, K2S, NaOH | Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток |
| Атомная | Атомы | Ковалентная | Простые вещества: алмаз (C), бор (B), кремний ( Si), германий (Ge) Сложные вещества: оксид кремния (IV)-SiO2 (песок) | Очень твердые, тугоплавкие, прочные, нелетучие, не растворимы в воде |
| Молекулярная | Молекулы | Между молекулами- слабые силы межмолекуляр-ного притяжения, а внутри молекул - прочная ковалентная связь | Твердые вещества при особых условиях, которые при обычных - газы или жидкости (О2, Н2, Cl2, N2, Br2, H2O, CO2, HCl); сера (S), белый фосфор (P), йод(I2); органические вещества, | Непрочные, летучие, легкоплавкие, имеют небольшую твердость |
| Металлическая | Атом-ионы | Металлическая | Металлы и сплавы Zn, Al, Fе, Cu | Ковкие, пластичные, обладают блеском, тепло- и электропроводны |








