Лучевая терапия в онкологии
В настоящее время лучевому лечению подвергается 60—70% онкологических больных, подлежащих антибластомному лечению. Исходя из стратегических задач оказания помощи больным со злокачественными новообразованиями, лучевая терапия может быть использована:
1) как самостоятельный, или основной, метод лечения;
2) в комбинации с хирургическим лечением;
3) в сочетании с химио-, гормонотерапией;
4) в составе мультимодальной терапии
Лучевая терапия как самостоятельный метод.
Лучевая терапия как самостоятельный метод лечения может быть проведена по радикальной программе, использована как паллиативное или симптоматическое средство.
Радикальная лучевая терапия направлена на полное излечение больного от опухоли и регионарных метастазов путем подведения канцерицидной дозы радиации. Применяется в случаях, когда является предпочтительной в косметическом или в функциональном отношении, а результаты одинаковы по сравнению с таковыми при применении других методов лечения онкологических больных (рак кожи, рак губы, опухоли средних отделов гортани, рак шейки матки). Уровни канцерицидных доз для различных опухолей неодинаковы и устанавливаются в зависимости от их гистологического строения, митотической активности и степени дифференцировки клеточных элементов. К опухолевому очагу должна быть подведена доза излучения 60—80 Гр, к зонам субклинического распространения — 40—50 Гр.
Паллиативная лучевая терапия предпринимается для уменьшения размеров опухоли и ее метастазов, стабилизации опухолевого роста и используется в тех случаях, когда невозможна лучевая терапия по радикальной программе. При этом суммарная очаговая доза (СОД), как правило, составляет 40— 50 Гр. Однако в процессе лучевого лечения эти дозы могут быть изменены. В случаях выраженной резорбции опухоли в ответ на лучевое воздействие и заметном улучшении общего состояния больного очаговая поглощенная доза может быть увеличена.
Симптоматическая лучевая терапия применяется для снятия или уменьшения клинических симптомов злокачественного поражения, способных привести к быстрой гибели больного или существенно ухудшающих качество его жизни. Облучение с симптоматической целью проводится по жизненным показаниям при поражении средостения с синдромом верхней полой вены, компрессионном синдроме, обусловленным быстро растущей опухолью головного мозга, острой асфиксии, связанной с быстро растущей опухолью трахеи, первичных и метастатических опухолях, вызывающих сдавление спинного мозга, что влечет за собой нарушение функции жизненно важных органов. Она может применяться для снятия болевого синдрома, остановки кровотечения.
Противовоспалительная и функциональная лучевая терапия применяется для лечения неопухолевых заболеваний с целью ликвидации послеоперационных и раневых осложнений, воспалительных и дегенеративных заболеваний костносуставного аппарата, сопровождающихся болевым синдромом при неэффективности традиционных методов лечения (антибиотикотерапии, гормонального лечения, физиотерапии и др.). Разовая доза излучения при острых воспалительных процессах составляет ОД—0,2 Гр, суммарная — 0,3—0,6 Гр; при хроническом воспалении — 0,3-0,5 Гр и 2,5—3 Гр; при дегенеративных изменениях в суставах — 0,5—0,8 Гр и 3—4 Гр соответственно.
Лучевая терапия как компонент комбинированного лечения.
В комбинации с хирургическим лечением – может быть использована как перед операцией (для уменьшения активности опухоли, уничтожения метостазов, снизить воспаление, либо же перевести опухоль в резектабельную при её обширности), так и после (с целью антибластики, чтобы уничтожить те клетки и метастазы, которые, возможно, остались в организме). Возможна так же интраоперационная лучевая терапия.
В комбинации с химиотерапией – для потенциирования действия обоих методов (то есть химия усиливает лучевую, а лучевая – химию). Так как, во-первых, они оказывают одно и то же действие на клетки, но в разных точках приложения (на разные фазы цикла, на разные структуры клетки) = эффект в 2 раза выше, а во-вторых, некоторые клетки находятся в «спящем» состоянии (фазе G0 митотического цикла), а химиопрепараты способствует выходу их из этой фазы.
Мультимодальная терапия онкологических больных предусматривает использование современных методов хирургического, лучевого и лекарственного лечения, а также сочетание их с радиомодифицирующими воздействиями (гипертермия, гипербарическая оксигенация, электрон-акцепторные соединения, гипоксическая гипоксия и др.).
-Как выбрать объем облучения? (Распределение дозы излучения в облучаемом объеме.): есть 3 объёма облучения, которые вычисляются по порядку и в итоге позволяют получить точное место облучения, учитывая различные факторы. 1. GTV (gross tumor volume) – «валовой, примерный, грязный) объём. Это объем опухоли, который мы получили на всех методах исследования (узи, кт, мрт и тд.)
2. CTV (clinical tumor volume) – объем расширяется, так как мы знаем, что единичные клетки и их комплексы расположены вокруг опухоли, за пределами её основной массы.
3. PTV (planning tumor volume) – учитывает смещение пациента и его органов во время одного сеанса облучения, а также от сеанса к сеансу.
-Как выбрать длительность и частоту? (Распределение дозы излучения во времени): Наибольшее распространение получил режим обычного, или «классического» фракционирования, при котором к опухоли подводится разовая очаговая доза (РОД) 1,8—2 Гр. Облучение проводится один раз в день пять дней в неделю, суммарная очаговая доза (СОД) за неделю составляет 9—10 Гр. Курс лечения продолжается 1,5 месяца до подведения к опухоли канцерицидной дозы.
Разработаны и продолжают изучаться нетрадиционные варианты фракционирования: среднего (РОД —3—4 Гр), крупного (РОД — 5 Гр и более), используемые преимущественно для предоперационного облучения опухолей, отличающихся высокой злокачественностью, а также с целью паллиативного и симптоматического лечения.
Большой интерес представляют курсы лучевой терапии, предусматривающие дополнительное дробление дневной дозы на две (и более) фракции с интервалами между фракциями менее одних суток (мультифракционирование). Различают следующие разновидности мультифракционирования:
1) ускоренное(акселерированное) – когда РОД такая же, как в классике, или даже ниже, количество облучений тоже такое же, но облучения проводятся 2-3 раза в день. Следовательно, СОД будет такая же или чуть ниже, но получена быстрее. Ускоренное фракционирование применяют для облучения быстро пролиферирующих опухолей;
2) гиперфракционирование – когда РОД значительно ниже, (1 Гр), количество облучений тоже 2-3 раза в день, но зато длительность остаётся такой же. Следовательно, СОД возрастает.. Гиперфракционирование применяется для облучения медленно растущих опухолей;
3) комбинированное фракционирование представляет собой варианты мультифракционирования, имеющие признаки как гиперфракционирования, так и ускоренного фракционирования, а иногда сочетающееся с обычным фракционированием дозы.
В зависимости от наличия перерывов в облучении различают: непрерывный курс лучевой терапии, при котором заданная поглощенная доза в мишени накапливается непрерывно; расщепленный курс облучения («сплит»-курс), состоящий из двух (или нескольких) укороченных курсов, разделенных продолжительными (2—4 недели) запланированными интервалами. За время перерыва в облучении здоровые ткани восстанавливают лучевые повреждения. Опухоль уменьшается в размерах, улучшается ее кровоснабжение, ведущее к улучшению оксигенации опухолевых клеток и повышению их радиочувствительности.
Динамическое фракционирование — облучение с планируемым изменением схемы фракционирования и(или) плана облучения больного. При этом подведение крупных фракций с мультифракционированием суточной дозы может сочетаться с классическим фракционированием.
Одномоментное облучение — планируемая суммарная поглощенная доза облучения подводится к опухоли за один сеанс. Такое распределение дозы излучения используется в настоящее время при интраоперационном облучении.
-Почему вообще лучевая терапия эффективна? Почему не убивает здоровые ткани в той же степени, в какой и опухоли? От чего зависят различия в РОД, СОД, времени облучения, количестве курсов? – Закон Бергонье-Трибондо – Чем чаще клетки делятся, и чем ниже степень их дифференцировки – тем чувствительнее они к ионизирующему излучению. Следовательно – опухоль является самой чувствительной к ИИ тканью в организме. И в зависимости от того, из каких клеток состоит опухоль, выбирается РОД, СОД, время облучения, количество курсов, оптимальное для того, чтобы максимально эффективно убить эту опухоль.
Получается, что если опухоль зародилась из ткани, которая изначально чувствительна к ИИ (лимфомы, опухоли яичек и яичников) – опухоль будет вообще хорошо чувствительна. Если из той ткани, которая резистентна к ИИ (рак почек, рак ПЖ, рабдомиосаркомы и все другие опухоли из мышечной ткани) – лучевая терапия поможет мало.
Однако гистологическое строение не определяет чувствительности нормальной и патологической ткани к излучению. Одна и та же ткань в зависимости от условий по-разному реагирует на воздействие излучения. Радиочувствительность опухолей и нормальных тканей не является чем-то постоянным и меняется в зависимости от многих факторов. Благодаря успехам радиобиологии появилась возможность искусственно влиять на радиочувствительность опухолевых и нормальных клеток с помощью применения физических и химических факторов — радиомодифицирующих агентов – физические и химические факторы, способные изменить (усилить или ослабить) радиочувствительность клеток, тканей и организма в целом.
Какие есть радиомодифицирующие методы? – 1. ГБО – так как повышает метаболизм в ткане опухоли – становится еще активнее и чувствительнее к ИИ
2. ЛС – электроноакцепторные соединения (ЭАС) – они повышают чувствительность только опухолевых, гипоксичных клеток, окисляя их свободным электроном. Сюда относится метронидазол, мезонидазол.
3. Малые (сенсебилизирующие) РОД (0,1 Гр) – за 3-5 минут до главного облучения.
4. Гипертермия – нагрев СВЧ или УВЧ полем до 43-45 градусов.
Виды излучений
Для облучения злокачественных опухолей используются корпускулярное (бета-частицы — β, 138 нейтроны — η, протоны — ρ, пи-минус-мезоны) и фотонное (рентгеновское, гамма-) излучения.
В качестве источников излучения могут быть использованы естественные и искусственные радиоактивные вещества, ускорители элементарных частиц. В настоящее время в клинической практике применяются преимущественно искусственные радиоактивные изотопы, получаемые в атомных реакторах, генераторах, на ускорителях.
Вид излучения выбирается в зависимости от той глубины, на которой расположена опухоль. Для кожных опухолей – рентгеновское излучение и быстрые электроны (не заторможенные). Для более глубоких – гамма-излучение. Для совсем глубоких – тормозное излучение быстрых электронов, протонное излучение.
Способы облучения
Все существующие способы облучения делятся на наружные и внутренние. Наружное облучение подразделяют на дистанционное и контактное. Дистанционное облучение осуществляется в двух видах — статическом и подвижном. Статическое облучение может быть однопольное, двупольное встречное (однозонное, многозонное), многопольное (одно- и многозонное) с использованием формирующих устройств (защитных блоков, клиновидных фильтров, решетчатых диафрагм, болюсов, выравнивающих устройств).
Может быть подвижное и неподвижное облучение
Наружное контактное – аппликационное, при необходимости воздействия на неглубоко расположенные и неинфильтрирующие окружающие ткани опухоли. При аппликационной бета-терапии радиоактивное вещество прикладывается непосредственно к коже или слизистой оболочке или находится на расстоянии 0,5 см. Аппликационная гамма-терапия применяется при опухолевых процессах, инфильтрирующих кожу и подлежащие ткани. Глубина инфильтрации не должна быть более 2—3 см. Дистанцирование при этом должно быть от 0,5 до 5 см.
Внутреннее облучение предусматривает введение радиоактивных источников (РИ) в организм и классифицируется как лечение с помощью закрытых РИ (брахитерапия) и открытых РИ (системная терапия). Внутриполостное облучение (источник излучения находится в естественной полости тела больного) и внутритканевое облучение (источник излучения находится в тканях тела больного) осуществляется по методике афтерлоадинг, при которой последовательно вводят эндо- или интростат в полость тела или в ткани, а затем источник излучения в эндо- или в интростат.
Внутреннее облучение с использованием радиоактивного йода 1311 применяется для лечения больных с метастазами рака щитовидной железы, 89Sr (метастрон) используется при множественном метастатическом поражении костей
В настоящее время созданы возможности не только для избирательного воздействия на отдельные опухоли, но и ее клетки путем получения к ним антител, меченных РИ (радиоиммунотерапией). В частности, для лечения злокачественных лимфом получен препарат, представляющий собой меченные 131*йод моноклональные антитела к поверхностному антигену СД20, выявленному в 95% случаев В-клеточной злокачественной неходжкинской лимфомы. Это позволяет использовать лучевую терапию не только как средство локального облучения опухолей, но и как способ общего воздействия при генерализованных формах злокачественных новообразований.
Химиотерапия
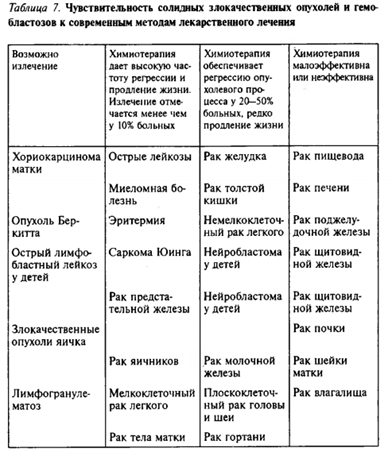 |
Химиотерапия злокачественных опухолей — это применение в клинической практике синтетических и природных лекарственных препаратов, тормозящих пролиферацию или необратимо повреждающих опухолевые клетки.
Но большинство цитостатиков оказывает ингибирующее действие на небольшую группу опухолей, а некоторые препараты имеют исключительно узконаправленное действие только на один вид новообразований.
Классификация химиопрепаратов по происхождению разделяет цитостатики на синтетические и природные.
К синтетическим относятся алкилирующие агенты и антиметаболиты.
К природным причисляют антибиотики, вещества растительного происхождения, ферменты и гормоны.
• Алкилирующие препараты (действуют на опухолевыеклетки в любой фазе клеточного цикла): хлорэтиламины, производные этиленимина, эфиры дисульфоновых кислот, производные нитрозометилмочевины.
• Комплексные соединения платины: цисплатин, оксалиплатин, карбоплатин.
•Антиметаболиты: антагонисты фолатов, фторпиримидины, прямые ингибиторы тимидилат синтетазы, аналоги дезоксицитидина, пуриновые антагонисты.
• Противоопухолевые антибиотики и близкие к ним препараты (действуют в любой фазе клеточного цикла): актиномицины, антрациклины, антрацендионы, флеомицины, группаауреловой кислоты, прочие.
• Препараты растительного происхождения: винкалкалоиды, эпиподофиллотоксины, таксаны.
• Ферментные препараты: производные камптотецина, аспарагиназа.
• Прочие препараты: эстрамустин, митотан, метил-ГАГ,преднимустин, ATRA (общая трансретиноидная кислота).
Лекарственное лечение с использованием одного цитостатика называют монохимиотерапией, применение комбинаций из нескольких противоопухолевых препаратов — комбинированной химиотерапией или полихимиотерапией. По степени выраженности лечебного эффекта полихимиотерапия имеет ряд преимуществ перед монохимиотерапией. В известных схемах полихимиотерапии уже подобраны определенные цитостатики, равнозначные по противоопухолевой активности, но отличные по механизму действия на клеточном и молекулярном уровнях. В связи с токсичностью цитостатиков для нормальных пролиферирующих клеток в схемы комбинированной химиотерапии включают препараты с разной степенью токсичности. Возможно включение других лекарственных средств, не обладающих противоопухолевой активностью, но снимающих побочный эффект
Адъювантная (дополнительная) химиотерапия — это использование противоопухолевых препаратов после радикального хирургического удаления первичного опухолевого очага с целью уничтожения клинически неопределяемых микрометастазов опухоли.
Неоадъювантная химиотерапия — это первоочередное применение лекарственного компонента в периоде до планируемого радикального хирургического лечения.
В зависимости от способа введения цитостатиков в организм различают системную, регионарную и локальную химиотерапии.
Системная химиотерапия рассчитана на общий резорбтивный эффект, который достигается при внутривенном, внутримышечном, подкожном, ректальном введении или приеме внутрь.
При регионарной химиотерапии цитостатик вводят непосредственно в сосуды, питающие пораженный орган. Например, регионарная терапия печени, почки, щитовидной железы осуществляется по этому принципу.
Локальная химиотерапия предполагает прямой контакт цитостатика с новообразованием при нанесении на кожу, введении в серозные полости — мочевой пузырь, плевральную, брюшную полости или интратекальное введение при поражении оболочек спинного мозга.
Доза препарата подбирается строго индивидуально, учитывая массу тела, возраст, нозологию ЗНО, гистологический тип ЗНО, размер ЗНО. Доза должно попадать в терапевтический коридор и быть субмаксимальной в этом коридоре.
Соблюдение принципов проведения интермиттирующего лечения в виде циклов с интервалами, свободными от лечения, также необходимо в связи с периодом восстановления нормальных тканей (костный мозг) от токсического повреждения. Цитогенетические исследования костного мозга в сопоставлении с изменениями в периферической крови — лейкопенией и (или) тромбоцитопенией — показывают, что восстановление наступает к 21-му дню и завершается полностью к 28-му дню. Именно эти сроки (считая от первого дня предыдущего цикла) используются на практике в качестве оптимальных для повторения курсов химиотерапии.








