Общая характеристика и хим свойства бора его получение
Бор — бесцветный, серое или красное кристаллическое либо тёмное аморфное вещество. Неметалл. Занимает по твердости второе место, после алмаза. В большинстве соединений бор проявляет степень окисления +3 (борный ангидрид В2О3, тетраборат натрия, бура Na2B4O7, борная кислота НзВОз, нитрид бора BN).
1. Взаимодействие с фтором
2В + 3F2 = 2BF3
2. Взаимодействие с кислородом
Бор реагирует с кислородом при 750 °С:
4В + 3О2 = 2В2О3.
3. Взаимодействие с другими неметаллами
При температуре выше 1200°С бор реагирует с хлором и азотом:
2В + 3Cl2 = 2BCl3,
2B + N2 = 2BN.
4. Восстановительные свойства
При сильном нагревании реагирует с устойчивыми оксидами:
3SiO2 + 4B = 3Si + 2B2O3.
5. Взаимодействие с кислотами
Кристаллический бор не взаимодействует даже с кипящими концентрированными растворами кислот. Аморфный бор окисляется горячими концентрированными растворами азотной, серной кислот и царской водкой:
B + 3HNO3 = H3BO3 + 3NO2.
6. Взаимодействие со щелочами
Со щелочами бор взаимодействуют только в присутствии окислителей:
4B + 4NaOH + 3O2 = 4NaBO2 + 2H2O.
Получение: 3Mg + В2О3 =3MgO + 2В
Борный ангидрид, борные кислоты и их соли: получение строение и свойства
Борный ангидрид 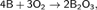
Борный ангидрид гигроскопичен, он бурно растворяется в воде B2O3 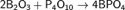
оксид бора взаимодействует с элементарным бором по реакции:
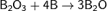
Сам оксид бора не восстанавливается углеродом даже при температуре белого каления, однако разлагается, если одновременно ввести в реакцию вещества, способные заместить кислород (хлор или азот):

Бо́рная кислота́ (ортоборная кислота) — слабая кислота, H3BO3. Борная кислота проявляет очень слабые кислотные свойства. Она легко вытесняется из растворов своих солей большинством других кислот. 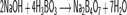
При нагревании борная кислота растворяет оксиды металлов, образуя соли.
Na2B4O7*10HOH+H2SO4=4H3BO3+Na2SO4+5HOH








