2. Методика выполнения определения массовой доли нитрита натрия в техническом продукте.
2.1СУЩНОСТЬ МЕТОДА.ХИМИЗМ.
Сущность метода определения массовой доли концентрации нитрита натрия заключается в окислении нитритов в кислой среде до нитратов перманганатом калия.
При этом протекают следующие реакции:
Окисление нитритов до нитратов перманганатом калия :
5NaNO2 + 2KMnO4 + 3H2SO4 → 5NaNO3 + 2MnO4 +K2SO4 + 3H2O
NO2- +H2O -2e → NO3- + 2H+ 2
10
MnO4- + 8H+ + 5e → Mn2+ + 4H2O 5
5NO2- + 2MnO4- + 6H+ → 5NO3- + 2Mn2+ + 3H2O
Титрование избытка перманганата калия оксалатом аммония :
2KMnO4 + 5(NH4)2C2O4+8H2SO4 → 2MnSO4+ K2SO4 + 5(NH4)2SO4+8H2O+10CO2
MnO4-+8Н++5е→Mn2++4 H2О 2
10
C2O42+ -2e → 2CO02 5
2 MnO4-+10H+ +5 C2O42-→2Mn2++8H2O+10 CO02
2.2МЕТОДИКА ВЫПОЛНЕНИЯ ОПРЕДЕЛЕНИЯ.
Приготовление раствора нитрита натрия.
Для приготовления раствора нитрита натрия необходимо рассчитать навеску.
Расчет навеки нитрита натрия:
Необходимо приготовить 100см3 раствора нитрита натрия с молярной концентрацией эквивалента 0,05 моль /дм3.
Решение:
mн 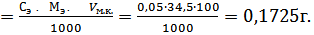
 М( NaNO2)=69 г/моль;
Э( NaNO2)= М( NaNO2)=69 г/моль;
Э( NaNO2)= 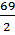 =34,5
Мэ( NaNO2)=34,5 г/моль. =34,5
Мэ( NaNO2)=34,5 г/моль.
|
Дано:
V=100см3
Сэ=0,05 моль /дм3
mн-?
Взятие навески:
mп.б=15,53165г
mб.с.н=15,70415г
mн=0,1725г
mп.б- масса пустого бюкса;
mб.с.н- масса бюкса с навеской;
mн-масса навески.
В мерную колбу емкостью 100см3 налила дистиллированной воды. Навеску без потерь перенесла в мерную колбу, перемешала до однородной массы и закрыла пробкой.
Проведение испытания.
В колбу для титрования цилиндром отмерила 30см3 раствора серной кислоты с молярной концентрации эквивалента 2 моль/дм3 ,нагрела почти до кипения , затем пипеткой добавила 10см3 приготовленного раствора нитрита натрия и пипеткой добавила 20см3 раствора перманганата калия , с молярной концентрацией эквивалента 0,05 моль /дм3.Колбу закрыла пробкой , хорошо перемешала и выдержала в темном месте 15 минут. По истечению этого времени содержание колбы нагрела и оттитровала стандартным раствором оксалата аммония до исчезновения окраски.
Провела три параллельных испытания и получила следующие объемы:
V1= 10,9см3
V2=10,9 см3
V3=10,9 см3
Vср(р)= 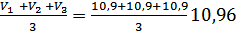 см3
см3
Выполнение “холостого” анализа.
В колбу для титрования цилиндром отмерила 30см3 раствора серной кислоты ,нагрела до кипения, пипеткой добавила 20см3 перманганата калия и содержимое колбы оттитровала рабочим раствором оксалата аммония до исчезновения розовой окраски.
Результаты титрования “холостой” пробы:
V1’= 20,2см3
V2’=20,3 см3
V3’=20,25 см3
Vср(х)= 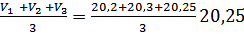 см3
см3
2.3ОБРАБОТКА РЕЗУЛЬТАТОВ АНАЛИЗА.
Массовую долю нитрита натрия в образце рассчитываю по формуле:
W % (NaNO2)= 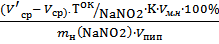
Результаты титрования анализируемого раствора нитрита натрия оксалатом аммония.
Vср(р)=10,96см3
Vср(х)=20,25см3
Мэ(NaNO2)=M(NaNO2)/1=126/2=34,5г/моль
Сэ(C2O4)=0,05 моль /дм3
K(C2O4)=1,00
mн(C2O4)=0,710г/моль
Титр оксалата аммония по нитриту натрия рассчитываем по формуле:
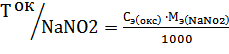
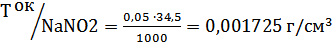
Определения массовой доли нитрита натрия в техническом продукте рассчитываем по формуле:
W % (NaNO2)= 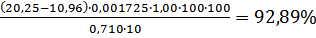
Где:
Сэ(C2O4)- молярная концентрация эквивалента раствора оксалата аммония (моль /дм3 );
Мэ(NaNO2)- молярная масса эквивалента нитрита натрия (г/моль );
K(C2O4)- поправочный коэффициент раствора оксалата аммония;
Т(NaNO2)-титр раствора оксалата аммония по нитриту натрия (г/см3);
mн(NaNO2)-масса навески нитрита натрия(г).
Vср(х)-средний объем раствора оксалата аммония,прошедшего на титрование “холостой” пробы(см3);
Определение массовой доли нитрита натрия в техническом продукте составляет 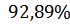 .
.
2.4 ВОЗМОЖНЫЕ ОШИБКИ АНАЛИЗА.
В результате выполнения анализа можно допустить следующие ошибки если:
1. Неточно взята навеска;
2. Неточно приготовлен раствор
3. Неточность вычисления в анализе
4. Допущена ошибка при расчете
5. Посуда не химически чистая
6. Не доведен объем в мерной колбе до мениска водой
7. При неправильно заполненной бюретке
8. Не убрана воронке из бюретки
9. Не заполнен носик бюретки
10. При повторном титровании не заполнили бюретку до нуля.








