1. Общая характеристика методов оксидиметрии. Перманганатометрия.
ВВЕДЕНИЕ
Титриметрический анализ (титрование) — метод количественного анализа, основанный на измерении объема раствора реактива известной концентрации, расходуемого для реакции с определяемым веществом.
В зависимости от типа используемых реакций можно выделить следующие методы титриметрического анализа:
- нейтрализация
- окисления-восстановления
- осаждения (аргентометрия)
- комплексообразования (комплексонометрия)
Процесс определения титра исследуемого вещества называется - титрованием.
Во всех химических реакциях взаимодействие различных веществ друг с другом происходит в соответствии с их эквивалентами, независимо от того, являются ли эти вещества простыми или сложными. используя в качестве интенсивности аналитического сигнала измерений объем титранта, пошедший на титрование, поэтому старое название метода - объемный анализ.
Точка эквивалентности (в титриметрическом анализе) — число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании кислот или же при титровании раствора, в котором присутствует несколько определяемых ионов.
1. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТОДОВ ОКСИДИМЕТРИИ. ПЕРМАНГАНАТОМЕТРИЯ.
1.1 ОБЩИЕ ПРЕДСТАВЛЕНИЯ.
В основе оксидиметрии лежат окислительно-восстановительные реакции. При помощи титрованных растворов окислителей определяют количественно содержание восстановителей и наоборот. Оксидиметрии подразделяется на ряд методов: перманганатометрию, йодометрию, хроматометрию, броматометрию и др.
Для окислительно-восстановительных реакций свойственно:
1. во многих реакциях взаимодействуют не только окислители и восстановители, но и другие вещества (например, кислоты и щелочи);
2. реакции часто протекают в несколько стадий, причем каждая из них протекает с различной скоростью;
3. скорость реакций окислении — восстановления ниже скорости ионообменных реакций. В то время как ионные реакции протекают практически мгновенно, окислительно-восстановительные требуют более или менее продолжительного времени и особых условий, обеспечивающих быстрое доведение процесса до конца;
4. возможно разное направление реакции при одних и тех же исходных веществах. Кроме того, в процессе реакции нередко образуются вещества, изменяющие ход самой реакции.
Требования окисления — восстановления, на основе которых осуществляется количественный анализ
1. реакция должна протекать в нужном направлении и быть практически необратимой;
2. не должно протекать побочных реакций;
3. реакции должны протекать с достаточной скоростью. Очень часто скорость реакции повышают искусственно. Ее можно увеличить повышением температуры, концентрации реагирующих веществ, изменением рН раствора и применением катализатора. Учитывая свойства веществ, в каждом анализе создают условия для достижении необходимой скорости реакции.
Окислитель — вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов.
Электрохимическое окисление позволяет окислять практически любые вещества на аноде, в растворах или в расплавах. Так, самый сильный неорганический окислитель, элементарный фтор, получают электролизом расплавов фторидов.
Сильные окислители
«царская водка» — смесь одного объема азотной кислоты и трёх объёмов соляной кислоты.
HNO3 + 3HCl ↔ NOCl + 2Cl + 2H2O
Восстановитель - вещество, способное отдавать электроны другому веществу (окислителю). Восстановлении кислорода для образования воды (2Н2+О2>2Н2О) водород является восстановителем. В биологических системах некоторые сахара являются восстановителями.
В методе оксидиметрии, применяются индикаторы которые сами являются окислителями или восстановителями. Подобные индикаторы, называемые редокс-индикаторами, легко переходят из окисленной формы в восстановленную и обратно, причем обе формы имеют различную окраску. К таким индикаторам относятся дифениламин, окисленная форма которого сине-фиолетовая, а восстановленная бесцветная, метиловый синий (окисленная форма зеленовато-голубая, восстановленная бесцветная) и др.
Для некоторых реакций имеются специфические реактивы, изменяющие окраску в эквивалентной точке данного титрования. Например, таким индикатором является крахмал, образующий с йодом адсорбционное соединение синего цвета. В некоторых случаях возможно титрование без индикатора, если окраска рабочего раствора достаточно яркая и резко изменяется в результате реакции. Примером может служить титрование с помощью раствора перманганата калия, раствор которого малинового цвета.
Методы оксидиметрии применяются в клиническом и санитарно-гигиеническом анализе. Методом перманганатометрии определяют количество кальция в крови. Этот метод применяется также для определения так называемой окисляемости воды, т. е. определения количества КМп04, необходимого для окисления органических веществ в сточных водах. Йодометрия используется для определения сахара в крови,свободного хлора в воде и активного хлора в хлорной извести.
1.2 ПЕРМАНГАНАТОМЕТРИЯ. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МЕТОДА.
Перманганатометрия – метод объемного (титриметрического) химического анализа, основанный на применении стандартного (имеющего строго определенную концентрацию) раствора перманганата калия KMnO4.
1.2.1 ТАБЛИЦА ИЗМЕРЕНИЯ ОКРАСКИ ПЕРМАНГАНАТА КАЛИЯ В ЗАВИСИМОСТИ ОТ СРЕДЫ:
| Среда в кислой среде в нейтральной среде в щелочной среде | Цвет бесцветный бурый осадок зеленый | Степень окисления марганца Mn+2 Mn+4 Mn+6 |
2KMnO4 + 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O;
2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH;
2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H2O;
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O
Окончание титрования устанавливается по отсутствию розовой окраски перманганат-иона или с помощью индикатора (например, дифениламина).Применение перманганатометрии несколько осложняется реакцией, которая может идти в конце титрования в случае недостаточной кислотности раствора и приводит к ошибкам аналитического определения восстановителей:
2MnO4- + 3Mn2+ + 2H2O = 5MnO2 + 4H+
Эта реакция ускоряется в присутствии диоксида марганца. Для подкисления раствора при перманганатометрии обычно используют серную кислоту, так как соляная кислота (хлорид-ионы) и азотная (примеси оксидов азота) могут окисляться перманганатом калия и тем самым искажать результаты титрования.
При хранении раствора перманганата калия идет его постепенное разложение с выделением кислорода и образованием марганца, что ведет к изменению концентрации исходного раствора.
1.3 ПРИГОТОВЛЕНИЕ РАБОЧИХ РАСТВОРОВ:
Особенности объёмного анализа:
Из реактивов, используемых для приготовления рабочих растворов ,редко можно приготовить растворы точной концентрации ,взяв навеску и растворив её в воде в мерной колбе .Это связанно с их гигроскопичностью ,летучестью. Поэтому для приготовления рабочих растворов точной концентрации используют установочные вещества . Это вещества ,имеющие строго определённый химический состав ,который не изменяется в процессе приготовления растворов . Точный раствор такого вещества можно приготовить растворение его навески в мерной колбе . Раствор рабочего вещества с приблизительной концентрацией и , титруя его раствором установочного вещества , определяют точную концентрацию рабочего раствора. Этот титрованный раствор используется для объемных аналитических определений .
Рабочим раствором в перманганатометричесим методе служат растворы оксалата аммония и перманганата калия.
Для приготовления рабочего раствора оксалата аммония необходимо рассчитать его навеску.
Расчет навески:
Необходимо приготовить 200см3 раствора оксалата аммония с молярной концентрацией эквивалента 0,05 моль /дм3.
Решение:
mн 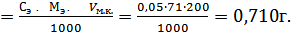 Мэ( NH4)C2O4H2 Мэ(NH4)2C2O4H2O)=
Мэ( NH4)C2O4H2 Мэ(NH4)2C2O4H2O)= 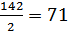 г/моль.
Ответ: Потребуется взвесить 0,710г/моль оксалата аммония
Отве г/моль.
Ответ: Потребуется взвесить 0,710г/моль оксалата аммония
Отве
|
Дано :
V=200см3
Сэ=0,05 моль /дм3
mн-?
В мерную колбу емкостью 200см3 на 1/3 залила дистиллированной водой, навеску оксалата аммония без потерь перенесла в мерную колбу , перемешала до однородной массы, закрыла пробкой.
Приготовления рабочего раствора перманганата калия :
Использовать дважды перегнанную дистиллированную воду (при вторичной перегонке к воде добавляют немного перманганата калия). Если нет возможности использовать бидистиллят, приготовленный раствор перманганат калия кипятят, охлаждают и отделяют выпавший осадок оксида марганца фильтрованием через стеклянный фильтр. Концентрацию (нормальность) раствора перманганата калия устанавливают титрованием точной навески щавелевой кислоты или оксалата натрия. Перманганатометрически определяют железо(2+), хром(3+), таллий(1+), вольфрам(V), ванадий(IV), сурьму(III), пероксид водорода, гидразин, органические вещества. Перманганатометрическое титрование применяется для определения очень сильных восстановителей, реагирующих с катионами железа(3+), переводя их в катионы железа(2+), которые оттитровывают перманганатом калия. Метод используется также для косвенных определений, например в феррометрии, суть которого заключается в восстановлении окислителей катионами железа(2+), избыток которого реагирует с перманганатом калия.Обратным перманганатометрическим титрованием определяют восстановители, медленно реагирующие с перманганатом калия – такие как иодиды, цианиды, тиоцианаты и т.п.
1.4 ПРИЁМЫ ТИТРОВАНИЯ В ПЕРМАНГАНАТОМАТРИИ.
- При прямом титровании к раствору определяемого вещества (аликвоте или навеске, титруемому веществу) добавляют небольшими порциям раствор титрант (рабочий раствор).
- При обратном титровании к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют его остаток, не вступивший в реакцию.
- При заместительном титровании к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют один из продуктов реакции между анализируемым веществом и добавленным реагентом.








