Электролиты в организме человека. Понятие об электролитном составе крови и водно-солевом обмене в организме. Роль рН в биологических жидкостях организма.
Электролиты – это минеральные соединения, которые способны проводить электрический заряд. Находясь в тканях и крови в виде растворов солей, они помогают перемещению питательных веществ в клетки и выводу продуктов обмена веществ из клеток, поддерживают в них водный баланс и необходимый уровень кислотности.
Электролиты крови
Калий – важная составляющая большинства клеток. Вместе с другими электролитами ионы калия отвечают за функционирование мышц и нервов, нормальный кислотно-щелочной баланс, водный обмен.
Натрий имеется во всех тканях и жидкостях организма. Он необходим для сокращения мышц, поддержания водно-солевого баланса. Макроэлемент всасывается в кишечнике из обычной столовой соли.
Хлор входит в состав многих биологически активных веществ, выполняет целый ряд физиологических функций.
Ионизированный кальций.
Водно-солевой обмен — совокупность процессов потребления воды и солей (электролитов), их всасывания, распределения во внутренних средах и выделения из организма.
Организм взрослого человека состоит на 65 % из воды (60-70 % от веса тела).
Синтез, распад и взаимопревращения (метаболизм) химических соединений в организме осуществляется с помощью белков-ферментов. Их насчитывается примерно 2 тысячи.
Ферменты наиболее активны в пределах узкой зоны рН и соответствуют области физиологических значений.
Подсчитано, что в процессе метаболизма ежесуточно в организме образуется большое количество кислых продуктов. Это может привести к сдвигу рН крови, различных тканевых жидкостей мозга, печени, почек и др., что резко отразится на активности ферментов. Например, сдвиг рН крови на 0,4 единицы приводит к летальному исходу, рН слюны меньше 5 единиц способствует развитию кариеса.
Постоянство рН различных биологических жидкостей обеспечивается благодаря наличию в организме многочисленных регулирующих систем: легкие , кишечник, почки, кожа и др.
Буферные растворы
30.Понятие о буферных растворах. Типы буферных растворов. Механизм действия буферных систем. Расчет рН буферных систем, влияние концентрации компонентов, разбавления на рН этих систем. Буферная емкость. Расчет буферных систем и приготовление буферных растворов с заданным значением рН. Буферные системы крови. Бикарбонатный буфер, уравнение Гендерсона-Гассельбаха.
Буферная система – протолитическая равновесная система, способная сохранять практически постоянное значение рН при добавлении небольшого количества кислоты или основания.
Механизм действия буферных растворов
Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
1. При добавлении небольшого количества хлороводородной кислоты, ионы Н+ связываются с имеющимся в растворе сопряженным основанием СН3СОО- в слабый электролит СН3СООН.
CH3COO ‾ +H + ↔ CH3COOH (1)
Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным.
2. При добавлении к буферу небольшого количества щелочи протекает реакция её с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾:
CH3COOН + OH ‾ ↔ CH3COO ‾ + H2O (2)
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В.Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным.
3. При разбавлении буфера рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными.
Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице.
Для кислотных буферных систем: рН = рК(кислоты) + lg 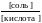 . Это уравнение называют уравнением Гендерсона – Гассельбаха.
. Это уравнение называют уравнением Гендерсона – Гассельбаха.
После аналогичного вывода для основных буферных систем:
рОН = рК(основания) + lg 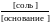 , рН =14 – рК(основания) + lg ([осн]/[соль])
, рН =14 – рК(основания) + lg ([осн]/[соль])
Изменение pH буферных растворов
1.Кислотного буфера
А) при добавлении кислоты:
рН = рКа + lg((Ссоли . Vсоли – Сдоб кисл . Vдоб кисл )/( Скисл . Vкисл + Сдоб кисл . Vдоб кисл))
Б) при добавлении основания:
рН = рКа + lg((Ссоли . Vсоли + Сдоб осн . Vдоб осн )/( Скисл . Vкисл - Сдоб осн . Vдоб осн))
2.Основного буфера
А) при добавлении кислоты:
рН = 14 - рКb + lg((Сосн . Vосн – Сдоб кисл . Vдоб кисл )/( Ссоли . Vсоли + Сдоб кисл . Vдоб кисл))
Б) при добавлении основания:
рН = 14 - рКb + lg((Сосн . Vосн + Сдоб осн . Vдоб осн )/( Ссоли . Vсоли - Сдоб осн . Vдоб осн))
Буферная ёмкость
Буферные емкость – количество вещества эквивалента кислоты или щелочи, которых нужно добавить к буферному раствору, чтобы изменить величину рН на 1.
рН крови =7.37 -7.45








