Константа гидролиза Кг характеризует способность данной соли подвергаться гидролизу. Чем больше Кг, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз.
Константа гидролиза зависит от ионного произведения воды КH2O и константы диссоциации слабодиссоциирующего соединения (слабого основания или (и) слабой кислоты, образующих данную соль).
Для соли, образованной сильной кислотой и слабым основанием константа гидролиза связана с константой диссоциации основания Косн зависимостью:
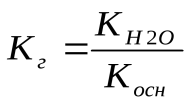 . (1) pH= 7- (0.5pKb + 0.5lgC)
. (1) pH= 7- (0.5pKb + 0.5lgC)
Для соли, образованной слабой кислотой и сильным основанием аналогичное соотношение связывает константу гидролиза с константой диссоциации кислоты Ккисл:
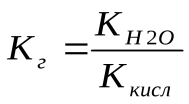 . (2) pH= 7+ 0.5pKa + 0.5lgC
. (2) pH= 7+ 0.5pKa + 0.5lgC
Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза связана с константами диссоциации кислоты и основания следующим соотношением:
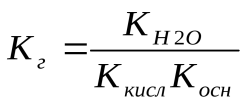 . (3) pH= 7+0.5pKa – 0.5pKb
. (3) pH= 7+0.5pKa – 0.5pKb
Если гидролиз протекает ступенчато, то каждая его ступень характеризуется своей константой гидролиза Например, при гидролизе карбоната натрия 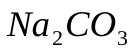 по первой ступени
по первой ступени
I. 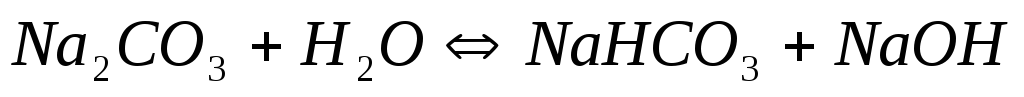
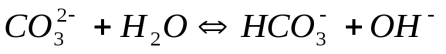
образуется ион 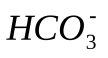 ,диссоциация которого характеризуется второй константой диссоциации угольной кислоты - 4,8 * 10 -11.
,диссоциация которого характеризуется второй константой диссоциации угольной кислоты - 4,8 * 10 -11.
При гидролизе по второй ступени образуется угольная кислота, диссоциацию которой характеризует первая константа ее диссоциации - 4,5 * 10 -7 (таблица 2).
II. 
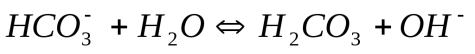
Поэтому константа гидролиза по первой ступени Кг,1 связана со второй константой диссоциации кислоты, а константа гидролиза по второй ступени Кг,2 – с первой константой диссоциации кислоты. Эта связь выражается соотношениями:
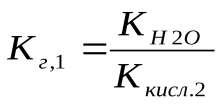
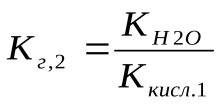 (4)
(4)
Поскольку первая константа диссоциации кислоты всегда больше второй, то константа гидролиза по первой ступени всегда больше, чем константа гидролиза по второй ступени.
- Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону. Реакция среды щелочная (pH > 7).
- Соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону. Реакция среды кислая (pH < 7).
- Соль, образованная слабым основанием и слабой кислотой, подвергается гидролизу по катиону и аниону. Характер среды определяется константами диссоциации образовавшихся слабых электролитов.
- При совместном гидролизе двух солей образуются слабое основание и слабая кислота: 2FeCl3 + 3Na2S +6H2O = 2Fe(OH)3 ¯ + 3H2S + 6NaCl – НЕОБРАТИМЫЙ ГИДРОЛИЗ или Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Соли, образованные слабой многоосновной кислотой, гидролизуются ступенчато. Гидролиз протекает в значительно большей мере по первой ступени. Это приводит к образованию кислых солей.
Растворы солей, образованных сильным основанием и слабой кислотой, имеют щелочную реакцию среды.
Гидролиз АТФ – реакция, протекающая в мышечных волокнах, при которой происходит взаимодействие АТФ с водой (гидролиз).
АТФ+Н2О→АДФ+Н3РО4 + энергия
В результате гидролиза 1 моль АТФ выделяется энергия, равная 30 кДж.
Энергия, выделяемая в результате гидролиза АТФ в мышечных волокнах, расходуется на: сокращение мышечных волокон (взаимодействие белков актина и миозина) и на их расслабление (работу кальциевого и натрий-калиевого насосов).








