Теплота гидратации ионов. Факторы, влияющие на теплоту гидратации (размер иона, заряд иона). Активность и коэффициент активности. Ионная сила растворов электролитов.
Физико-химический процесс взаимодействия частиц растворенного вещества с молекулами воды (растворителя) называется гидратацией. В процессе гидратации образуются сложные пространственные структуры, называемые гидратами, при этом в окружающую среду выделяется энергия. Тепловой эффект реакции образования 1 моль гидратированной соли из безводной соли называется теплотой гидратации.
Приближенно теплота гидратации вещества может быть определена как разность между теплотами растворения безводной соли и ее кристаллогидрата:
ΔНгидр = ΔНбезв – ΔНкрист (3)
где ΔНгидр - теплота гидратации молекул;
ΔНбезв - теплота растворения безводной соли;
ΔНкрист - теплота растворения кристаллогидрата.
Нетрудно догадаться, что энтальпия гидратации зависит от заряда и размера гидратируемого иона. В ряду ионов с однотипной электронной конфигурацией энтальпия гидратации возрастает с уменьшением размера иона.
Степень гидратации различных ионов и молекул неодинакова и зависит как от величины зарядов этих частиц, так и от их размеров. Чем больше заряд и меньше размеры, т. е. чем выше удельная плотность заряда, тем сильнее выражена гидратация. Таким образом, гидратные оболочки удерживаются электростатическими силами притяжения.
Ионная сила раствора (I) - величина, характеризующая интенсивность электростатического ноля всех ионов в растворе, которая равна полу-сумме произведений молярной концентрации (с) каждого иона на квадрат его заряда (z):
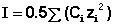
Активность электролита – эффективная концентрация иона, в соответствии с которой он участвует в различных процессах
Отношение активности вещества в данном растворе к его концентрации называется коэффициентом активности.
Коэффициент активности - это своеобразный поправочный коэффициент, показывающий, насколько реальность отличается от идеала.
25 Теории кислот и оснований. Протолитическая теория кислот и оснований (теория Бренстеда-Лоури). Сила кислот и оснований. Водные растворы кислот и оснований. Ионное произведение воды.
Сила кислоты определяется ее способностью отдавать протон, т.е сильная кислота - активный донор протона.
Сила основания определяется его способностью принимать протон, т.е сильное основание - активный акцептор протона.
Для удобства оценки характера водной среды используют водородный показатель pH. Это количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода. pH =- lg [ H +] Иногда используют гидроксильный показатель pOH. В нейтральной среде водородный показатель =7, в кислой он меньше 7 а в щелочной – больше. Для определения кислотности среды используют индикаторный или ионометрический метод.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.
Вода является очень слабым электролитом.
Ее диссоциация выглядит так:
Константа последнего равновесия равна:
Отсюда:
Диссоциация воды - равновесный процесс. Ионное произведение воды как разновидность константы равновесия. Условия нейтральности среды. Кислая и щелочная среда в водных растворах. Расчет концентрации ионов Н+ и ОН- в растворах сильных и слабых кислот и оснований. Водородный и гидроксильный показатели. Границы изменения рН водных растворов в зависимости от температуры, концентрации электролитов.
Как любой равновесный процесс диссоциацию слабых электролитов можно характеризовать константой равновесия. Если уравнение диссоциации представить в общем виде:
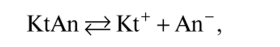
то константа равновесия, которая в данном случае называется константой диссоциации (или ионизации) будет равна:
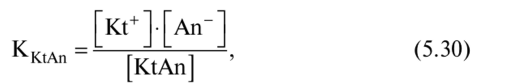
где [Kt+J и [Ап ] — равновесные концентрации соответствующих
ионов в растворе; [KtAn] — равновесная концентрация недиссо- циированных молекул в растворе.
Чем сильнее диссоциирует электролит, тем больше его константа диссоциации. Для сильных электролитов, диссоциирующих нацело, [KtAn] = 0. Поэтому константа диссоциации для них бесконечно большая величина, лишенная физического смысла.
В разбавленных растворах слабых электролитов константа диссоциации не зависит от концентрации в отличие от степени электролитической диссоциации а. Однако эти характеристики взаимосвязаны. Поскольку при диссоциации одной молекулы KtAn образуется один анион Ап- и один катион Kt+, концентрация диссоциированных молекул: Сдисс = |^An ] = [^t+]. Эту величину можно выразить
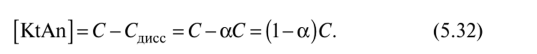
через ос (уравнение 5.27): Сдисс = осС,, где С — общая концентрация электролита. Отсюда

Выразим равновесную концентрацию недиссоциированного электролита как разность:
Подставив в выражение константы диссоциации (5.30) концентрации [An-J, [Kt+] из (5.31) и [KtAn] из (5.32), получим

или
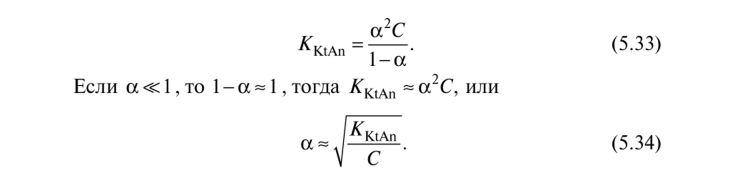
Это соотношение называется законом разбавления Оствальда. Из него следует, что при разбавлении раствора слабого электролита, т.е. при уменьшении концентрации, степень диссоциации его возрастает. Это хорошо согласуется с принципом смещения равновесий Ле Шателье: при разбавлении увеличивается концентрация воды, равновесие диссоциации (5.29) смещается в сторону связывания воды ионами, т.е. в сторону диссоциации.
В водных растворах кислот и оснований рН среды зависит от природы и концентрации растворенного вещества.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.
Вода является очень слабым электролитом.
Ее диссоциация выглядит так:
Константа последнего равновесия равна:
Отсюда:
Постоянство ионного произведения воды означает, что в любом водном растворе-нейтральном, кисломилищелочном-имеются и водородные ионы, и гидроксид-ионы.
Температура влияет на диапазон рН
В процессе нагрева диапазон изменяется, и при температуре 125 °C диапазон значений pH сужается до 0–12. Но тогда нейтральному раствору будет соответствовать pH 6, а при pH 7 раствор будет щелочным!
рН = –lg[Н+]; эта величина может изменяться в небольших пределах – всего от –1 до 15 (а чаще – от 0 до 14). При этом изменению концентрации ионов Н+ в 10 раз соответствует изменение рН на одну единицу.
Гидролиз солей. Причина и следствие гидролиза. Механизм гидролиза солей. Степень гидролиза и факторы, влияющие на нее. Константа гидролиза как разновидность константы равновесия. Вывод константы гидролиза и связи ее со степенью гидролиза солей. Случаи гидролиза: соли слабой кислоты и сильного основания, соли слабого основания и сильной кислоты, соли слабой кислоты и слабого основания. Реакции среды во всех случаях гидролиза и расчет рН. Гидролиз солей многовалентных ионов. Образование кислых и основных солей при гидролизе. Случаи необратимого гидролиза солей. Роль гидролиза в биохимических процессах (гидролиз АТФ - универсальный источник энергии в организме).

Причина гидролиза – образование слабодиссоциированных или труднорастворимых продуктов. Следствием гидролиза является нарушение равновесия в системе H2O  H+ + OH— ; в результате среда становится либо кислой (рН < 7), либо щелочной (pH > 7).
H+ + OH— ; в результате среда становится либо кислой (рН < 7), либо щелочной (pH > 7).
Механизм гидролиза. Для разных типов соединений он различен. Так, гидролиз солей можно рассматривать:
во-первых, как процесс, обратный реакциям нейтрализации; реакция нейтрализации между различными по силе кислотами и основаниями не всегда протекает до конца вследствие протекания обратного процесса – гидролиза образующейся соли,
во-вторых, как результат поляризационного взаимодействия ионов соли с их гидратной оболочкой (все ионы в растворе гидратированы); чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз.
Факторы, влияющие на степень гидролиза:
1. Полярность и поляризуемость хим. связи
2. Диэлектрическая проницаемость среды
3. Концентрация раствора: с повышением концентрации степень уменьшается
4. Диссоциация – эндотермический процесс: с повыш температуры повышается.
h= Nгидр/Nисх=(Kг/Cm)0.5 Кг – константа гидролиза








