Учение о растворах. Коллигативные свойства растворов.
18. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обусловливающие ее уникальную роль как единственного биорастворителя. Автопротолиз воды. Константа автопротолиза воды.
Организм человека на 60% состоит из воды, из них 42 приходится на внутриклеточную жидкость, а остальная часть на внеклеточную.
Вода – компонент высокоорганизованных процессов, универсальный растворитель.
Свойства воды:
1) высокое поверхностное натяжение(σ = 7,6 10-3Н \ м)
2) низкая вязкость
3) обладает большой теплотой испарения
4) высокая теплоемкость
5) высокий дипольный момент, связан со строением воды.
На двух гибридных орбиталях находятся по 2 неподеленных пары электронов, что обуславливает сильный отрицательный заряд, электронная плотность водорода смещается к кислороду, что обеспечивает положительный заряд на атоме водорода.
6)имеет аномально высокие температуры кипения и плавления – способность образовывать водородные связи.
7)Высокая диэлектрическая проницаемость (ξ = 78,8)
2.3. Автопротолиз воды
Н20 - основной растворитель в биологических системах, является амфолитом, способным самопроизвольно подвергаться слабой электролитической диссоциации или реакции автопротолиза:
2H2O ← → H3O+ + OH- ИЛИ H2O ← → H+ + OH-
Константа этого протолитического равновесия в соответствии с законом действующих масс равна:
Кс = [ОН-][Н30+]/[Н20]2 ИЛИ [OH-][H+]/[H2 O]. Равновесная концентрация растворителя [Н20] практически является величиной постоянной, т. к. концентрация молекул Н20, распавшихся на ионы, по сравнению с концентрацией недиссоциированных молекул, как правило, очень мала. Поэтому две константы Кс и [Н20] объединяют в одну константу Ks = Кс • [Н20]2, отсюда Ks = [ОН" ] • [Н30+]. Индекс "s" - первая буква английского слова solvent - растворитель, для воды принят индекс "в" - вода.
Величину Ksназывают ионным произведением растворителя или константой автопротолиза растворителя.
Для воды = Ks = [ОН-] • [Н30+] = 1 • 10-14 при t = 25°С.
Автопротолиз воды процесс эндотермический.
Также легко проходит и обратный процесс:
Н3О++ОН-=2 Н2О или упрощенно
Н2О = Н++ОН-
Константа данного равновесия при 22 градусах равна:
Ка = [H+] [OH-] / [H2O] = 1.82 *10 -16
19.Зависимость растворимости веществ в воде от соотношения гидрофильных и гидрофобных свойств; влияние внешних условий, на растворимость. Термодинамика растворения. Понятие об идеальном растворе.
При растворении дифильных веществ происходит изменение структуры воды как результат взаимодействия с гидрофобными группами сводится к минимуму. Гидрофобные группы, ассоциируясь, выталкивают молекулы воды из области своего расположения.
Термодинамика процесса растворения ΔG = (ΔH – TΔS) < 0.
ΔH – энтальпийный фактор, TΔS – энтропийный фактор. При растворении жидких и твёрдых веществ энтропия системы обычно возрастает (ΔS>0), т. к. растворяемые вещества из более упорядоченного переходят в менее упорядоченное.
При растворении газов ΔS<0, т. к. вещество из менее упорядоченного переходит в более упорядоченное, а снижение T способствует растворению газов.
Идеальными называются растворы, образование которых не сопровождается ни тепловыми, ни объемными изменениями системы (dH = 0, dV = 0). Свойства идеальных растворов не зависят от природы растворителя и растворенного вещества, а зависят только от количества частиц. При этом не имеют места какие-либо взаимодействия между частицами растворенного вещества и растворителя.
20. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константы ионизации слабого электролита. Закон разбавления Оствальда.
Электролиты– это вещества с ионными или сильнополярными ковалентными связями в водных растворах, подвергающиеся электролитической диссоциации.
Сильные электролиты– вещества, способные диссоциировать нацело. К ним относится большинство солей, а так же некоторые вещества молекулярного строения (HCl).
Слабые электролиты- диссоциируют в незначительно степени, и преобладающей формой их является молекулярная (H2S, органические кислоты).
Степенью электролитической диссоциации называется отношение количества электролита, распавшегося на ионы, к общему количеству растворенного электролита.
Количественно способность молекулярного электролита к диссоциации определяется степенью ионизации(она зависит от концентрации электролита):
α= 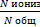 ,
,
где Nобщ – общее число молекул в растворе;Nиониз – число молекул, распавшихся на ионы.
Константа ионизации:
Kd= 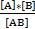 ,
,
Где [A],[B] – распавшиеся ионы
[AB] – не распавшееся на ионы вещество.
Закон разбавления Оствальда:
K= α2c/1- α ,
Где α – степень ионизации
С – молярная концентрация
При малых значениях α : K= α2c
Общая характеристика растворов как гомогенных систем. Виды растворов. Растворимость. Ненасыщенные, насыщенные и пересыщенные растворы. Растворимость газов. Законы Генри, Дальтона, Сеченова. Растворимость жидких и твердых веществ. Тепловые эффекты и термодинамика растворения веществ. Сольватная теория растворов.
Раствором называется гомогенная система, состоящая из двух и более компонентов, один из которых является растворителем, а остальные — растворенными веществами. Схематично состав раствора можно представить так:
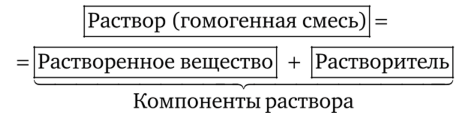
Растворы бывают не только жидкими, но твердыми(сплавы) и газообразными(смеси газов). Отличительной особенностью растворов является то, что они состоят из двух и более веществ, причем эти вещества настолько перемешаны, что составляют гомогенные системы.
Растворителем является то вещество, которое находится в избытке и в таком же агрегатном состоянии, что и раствор.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.
Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества. Концентрация насыщенного раствора (растворимость) для данного вещества при строго определенных условиях (температура, растворитель) — величина постоянная.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.








