Реакция нулевого порядка
Кинетическое уравнение имеет следующий вид:
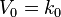
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка
Кинетическое уравнение реакции первого порядка:
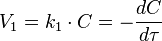
Приведение уравнения к линейному виду даёт уравнение:
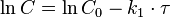
Реакция второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
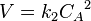
или
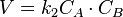
Измерение скорости реакции основано на определении концентрации одного из реагирующих веществ через различные промежутки времени от начала реакции. Для определения концентраций можно применять методы физико-химического анализа, основанные на зависимости физических свойств смеси от её состава (например, определение показателя преломления, угла вращения плоскости поляризации, вязкости, электрической проводимости, объёма, плотности, изменения температур замерзания и кипения, интенсивности окраски и т. п.), и методы аналитической химии (например, титрование).
К сравнительно медленным реакциям со временем полупревращения порядка получаса и более можно применять спектроскопию, масс-спектрометрию и хроматографию.
Для определения порядка реакции необходимо иметь экспериментальные данные об изменении концентрации реагирующих веществ со временем. Если в реакции участвует несколько веществ, то пользуются методом изолирования Оствальда.
14.Зависимость скорости реакции от температуры. Правило Вант - Гоффа. Температурный коэффициент скорости реакции и его особенности для биохимических процессов.
Правило Вант-Гоффа

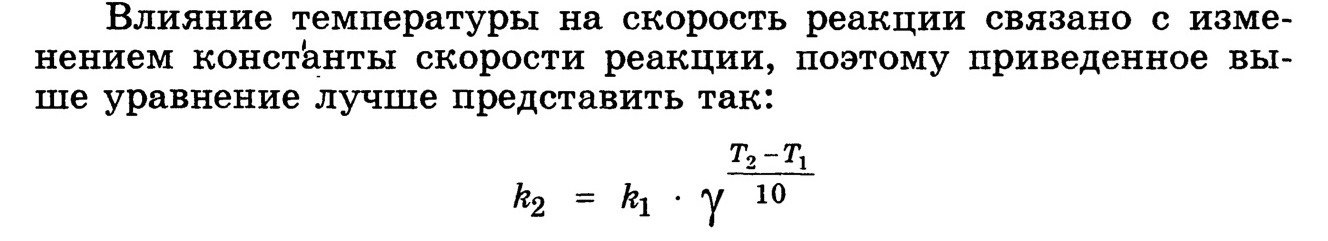
15.Понятие о теории активных соударении. Энергетический профиль реакции; энергия активации; уравнение Аррениуса. Роль стерического фактора. Понятие о теории переходного состояния .
Теория активных соударений.  Энергетический профиль течения реакции
Энергетический профиль течения реакции
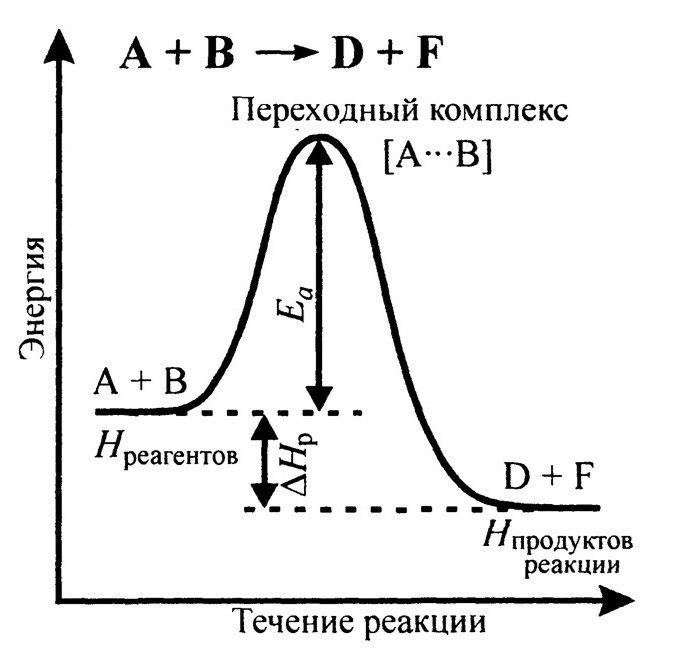
Энергия активации
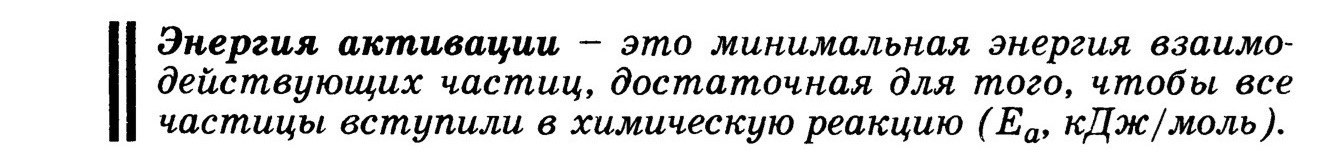
Зависит от природы реагирующих частиц, пути прохождения реакции, НЕ зависит от температуры.

Если доля активных молекул превышает 10^-7, то реакция протекает практически мгновенно, а если меньше 10^-18, то при данных условиях реакция практически не идет.
Уравнение Аррениуса

Чем больше энергия активации, тем меньше будут константа и скорость химической реакции, так как в системе будет меньше число активных частиц.
Стерический фактор (P)
-фактор, отражающий влияние на скорость химической реакции определенного расположения молекул реагентов в момент соударения.
Роль стерического фактора:
Стерический фактор характеризует вероятность реакции между молекулами, энергия которых больше или равна энергии активации и учитывает необходимость определенной ориентации реакционноспособных молекул в момент столкновения.
Переходное состояние
- это некая совокупность атомов, в которых старые связи еще не до конца разрушены, а новые еще не в полной мере образовались.
Переходное состояние (активный комплекс) нестабильно и существуют 10^-13 сек. Затем оно может перейти в частицы продуктов реакции или исходных веществ.
Чем больше энтропия, тем быстрее протекает процесс.
16. Катализ. Положительный и отрицательный катализ. Гомогенный и гетерогенный катализ Энергетический профиль каталитической реакции.
Катализ – это изменение скорости химической реакции в присутсвии веществ, не расходующихся в ходе реакции.
Увелечение скорости реакции называют положительным катализом
Уменьшение скорости реакции называют отрицательным катализом
Ингибитор – вещества вызывающие отрицательный катализ
Гомогенный катализ - катализатор и реакционная смесь находятся в одной фазе. Скорость пропорциональна количеству катализатора(омыление сложных эфиров) H2О2 + I → H2О + IO; H2О2 + IO → H2О + О2 + I
Гетерогенный катализ - катализатор обычно твердый, а реакция протекает на его поверхности. Скорость зависит от площади и состояния катализатора, т.к. реакция проходит на активных центрах(водный раствор пероксида водорода взаимодействует с оксидом марганца
17. Ферментативный катализ. Особенности каталитической активности ферментов. Уравнение Михаэлиса - Ментен и его анализ.
Ферменты - белковые молекулы, которые катализируют химические реакции в живых системах. Каталитической активностью обладают только активные центры молекулы. Имеется аллостерический центр, назначение которого состоит в распознавании субстрата и его размещении в активном центре.
Различия между ферментами и неорганическими катализаторами:
1) Скорость ферментативных реакций выше, чем реакций, катализируемых неорганическими катализаторами.
2) Ферменты обладают высокой специфичностью к субстрату.
3) Ферменты по своей химической природе белки, катализаторы - неорганика.
4) Ферменты работают только в определенном диапазоне температур (обычно в районе 37 град. С плюс/минус 2-3 град. С). , а скорость неорганического катализа возрастает в 2-4 раза при повышении температуры на каждые 10 град. С по линейной зависимости (правило Вант-Гоффа) .
5) Ферменты подвержены регуляции (есть активаторы и ингибиторы ферментов) , неорганические катализаторы работают нерегулируемо.
6) Ферментативные реакции протекают только в физиологических условиях, т. к. работают внутри клеток, тканей и организма (это определенные значения температуры, давления и рН).
Для каждой ферментативной реакции промежуточной стадией является присоединение к активному центру фермента молекулы субстрата. Образование фермент-субстратного комплекса приводит к перераспределению электронов в молекуле субстрата, что уменьшает прочность разрываемых связей и приводит к уменьшению энергии активации.
При данной концентрации фермента скорость зависит от концентрации субстрата. При низких концентрациях субстрата реакция имеет первый порядок о субстрату, а при высоких - нулевой. Достижение реакцией предельной скорости объясняется наличием в среде определенной концентрации фермента и тем, что его активные центры заняты. Дальнейший рост концентрации субстрата уже не будет вызывать изменения фермент-субстратного комплекса в системе.
Где Км = (к-1+к2)/к1 – константа Михаэлиса, k-1 - константы скоростей прямой и обратной реакций образования фермент-субстратного комплекса; k2 - константа скорости образования продукта, S – концентрация субстрата.








