Уравнения изотермы и изобары химической реакции. Прогнозирование смещения химического равновесия. Понятие о буферном действии, гомеостазе и стационарном состоянии живого организма.
Уравнение изотермы химической реакции:
ΔG0= -RTln Kp
Уравнение изобары
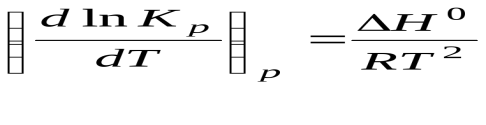
Изменения, которые происходят в обратимой системе в результате внешних воздействий, определяются принципом Ле Шателье.
Принцип Ле Шателье
если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие сместится в сторону той реакции (прямой или обратной) которая ослабит это внешнее воздействие.
Факторы, влияющие на смещение химического равновесия:
1. Изменение температуры
При повышении температуры равновесие сместится в сторону эндотермической (Q<0) реакции, при понижении температуры — в сторону экзотермической (Q>0) реакции.
2. Изменение давления в системе
Давление влияет только на обратимые газовые реакции, причём только на те из них, в которых происходит изменение общего числа молекул газа.
Увеличение давления смещает равновесие в сторону уменьшения общего числа молекул газообразных веществ, а уменьшение давления — в сторону увеличения числа молекул газообразных веществ.
Если реакция протекает без изменения числа молей газообразных веществ, то изменения давления не влияет на смещение равновесия.
3. Концентрация веществ
Если в равновесную систему ввести какое-либо из участвующих в реакции веществ, то равновесие сместится в сторону той реакции, при протекании которой это вещество расходуется.
Если из равновесной системы вывести какое-либо из участвующих в реакции веществ, то равновесие сместится в сторону той реакции, при протекании которой это вещество образуется.
Таким образом, увеличение концентрации исходных веществ и удаление продуктов реакции приводит к смещению равновесия в сторону прямой реакции. Наоборот, уменьшение концентрации исходных веществ и введение в систему продуктов реакции приводит к смещению равновесия в сторону обратной реакции.
Способность некоторых растворов сохранять неизменной концентрацию ионов водорода получила название буферного действия, которое является основным механизмом протолитического гомеостаза.
Гомеостаз – относительное динамическое постоянство состава и свойств внутренней среды организма, обуславливающее устойчивость его физиологической функции.
Стационарное состояние– состояние системы, при котором ее параметры со временем не изменяются, но происходит обмен веществом и энергией с окружающей средой. У живых организмов – гомеостаз.








