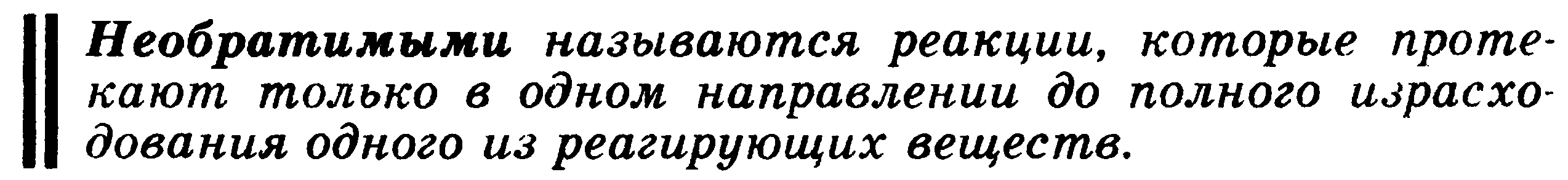∆S>0 (S2-S1>0) реакция пойдет → ∆G>0
∆S<0 реакция пойдет ←
Несогласованное действие факторов наблюдается в двух случаях:
1) ∆Hr> 0 и ∆Sr> 0 — самопроизвольному протеканию реакции способствует энтропийный фактор, отрицательное значение изменения энергии Гиббса возможно при соотношении |∆Sr |> |∆Hr|, т. е. при достаточно высоких температурах. Примером процессов этого типа является тепловая денатурация белков;
2) ∆Hr< О и ∆Sr< О — благоприятствующим фактором является энтальпийный, соотношение AGT< 0 наблюдается при |∆Hr| >|∆Sr |, т. е. при достаточно низких температурах. Пример процессов этого типа — гидратация белков.
8 . Термодинамические условия равновесия. Стандартная энергия Гиббса образования вещества, стандартная энергия Гиббса биологического окисления вещества. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме. Принцип энергетического сопряжения.

Под стандартной энергией Гиббса биологического окисления ΔG°, понимают изменение энергии Гиббса при реакции биологического окисления 1 моль вещества, находящегося в стандартном состоянии.
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии.

Принцип энергетического сопряжения:
Сопряженные реакции – это реакции, в которых протекание одной реакции обусловлено протеканием другой, невозможной в отсутствии первой. Принцип энергетического сопряжения заключается в том, что энергия необходимая для протекания эндергонической реакции поступает за счет осуществление экзэргонической реакции , причем в двух реакциях присутствует общее веществ- интермедиан.
dG<0 – экзергонический процесс ( без притока энергии извне). Это гликолиз, электролитическая диссоциация, гидролиз АТФ)
dG>0 – эндэргонический процесс (нужна энергия извне). Это фотосинтез.
9. Химическое равновесие. Обратимые и необратимые по направлению реакции. Термодинамические условия равновесия в изолированных и закрытых системах. Константа химического равновесия.