Δ Hof , i - стандартная энтальпия образование веществ
vi – стехиометрические коэффициенты
Следствие 2. Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
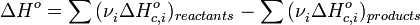
Δ Ho с, i - стандартная энтальпия сгорания веществ
vi – стехиометрические коэффициенты
Следствие 3. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
6.Второе начало термодинамики. Формулировка. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия как критерий возможности протекания самопроизвольных процессов.
Второе начало термодинамики: В изобарно-изотермических условиях (р, Т = const) в системе самопроизвольно могут протекать только такие процессы, в результате которых энергия Гиббса системы уменьшается (ΔG < 0). В состоянии равновесия G = const, G = 0

Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы.

Энтропия – энтропия – функция состояния, приращение которой ΔS равно теплоте Qмин подведённой к системе в обратимом изотермическом процессе, делённой на абсолютную температуру T, три которой осуществляется процесс: Δ S = Q мин/ T или мера вероятности пребывания системы в данном состоянии – мера неупорядоченности системы.

7. Энергия Гиббса – главный критерий возможности протекания самопроизвольных процессов. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов.


Критериями направления самопроизвольного протекания необратимых процессов являются неравенства ΔG < 0 (для закрытых систем), ΔS > 0 (для изолированных систем).
Если величина ΔG имеет отрицательный знак (ΔG < 0), то реакция самопроизвольно может протекать только в прямом направлении. Причем абсолютное значение разности ΔH – TΔS = ΔG будет определять движущую силу данного процесса.
Если же ΔG > 0, то в условиях, для которых были измерены ΔH и TΔS, в прямом направлении данная реакция протекать не может. Зато осуществимой окажется обратная реакция, для которой ΔG будет иметь отрицательное значение.
Реакции, для которых ΔH < 0, а ΔS > 0, могут самопроизвольно протекать в прямом направлении при любых температурах, т.к. ΔG у них всегда будет меньше нуля. Примером такой реакции может служить гидролиз пептидов или белков.
Если для химической реакции ΔH > 0, а ΔS < 0, то ее самопроизвольное протекание в прямом направлении всегда неосуществимо, т.к. энергия Гиббса в данном случае возрастает.
В случае ΔH > 0 и ΔS > 0 самопроизвольному протеканию реакции в прямом направлении способствует энтропийный фактор. При низких температурах отрицательное значение ΔH – TΔS может быть невозможно, но при нагревании – оно возможно и реакция становится осуществимой в прямом направлении. Например, тепловая денатурация белковых молекул.
Если ΔH < 0 и ΔS < 0, то отрицательное значение ΔG такой химической реакции наблюдается только при достаточно низких температурах.
При вычислении ΔG в химической реакции можно использовать следствие из закона Гесса, применяемое для расчета ее теплового эффекта (изменения энтальпии). В данном случае оно будет звучать следующим образом.
В ходе самопроизвольного процесса в закрытых системах G уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Система переходит в состояние химического равновесия (ΔG= 0). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔrH), так и энтропийным (TΔrS) фактором. Для реакций, у которых ΔrH< 0 иΔrS> 0, энергия Гиббса всегда будет убывать, т.е.ΔrG< 0, и такие реакции могут протекать самопроизвольно при любых температурах
В изолированных системах энтропия приобретает максимально возможное для данной системы значение Smax; в состоянии равновесияΔS= 0
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю. В самопроизвольной реакции:
∆G<0 (G2-G1<0)








