3 Типы термодинамических систем (изолированные, закрытые, открытые). Типы термодинамических процессов (изотермические, изобарные, изохорные). Стандартное состояние.
При изложении основных положений термодинамики пользуются набором определенных строго сформулированных понятий, начальное из которых – понятие термодинамической системы, являющейся объектом исследования в термодинамике.
Под термодинамической системой подразумевают избранную совокупность тел или веществ, состоящую из большого числа структурных единиц (молекул, атомов, ионов) и отделенную от окружающей внешней среды определенной границей или поверхностью раздела. Внешнюю среду или внешний мир представляет собой то, что находится вне оболочки системы.
В зависимости от свойств поверхности раздела, термодинамические системы делятся, в первую очередь, на изолированные, закрытые иоткрытые (рис. 2).
Изолированные системы не могут обмениваться с окружающей средой ни веществом, ни энергией. Закрытые системы обмениваются с внешним миром только энергией, а открытые – и веществом, и энергией.
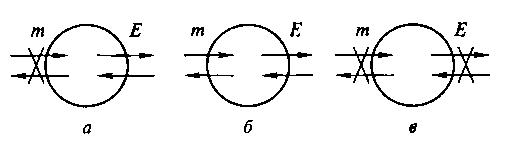
Рис. 2. Примеры закрытой (а), открытой (б) и изолированной (в) систем
Следует подчеркнуть, что реальные системы никогда не бывают абсолютно изолированными, они лишь в той или иной степени приближаются к данному понятию, но полностью с ним не совпадают.
Существуют такие процессы, в ходе протекания которых остаются неизменными только один или несколько параметров системы, а все остальные меняются. Так, процесс, протекающий при постоянной температуре, называется изотермическим, при постоянном давлении – изобарным, а при постоянном объеме – изохорным. Если неизменными остаются температура и давление или температура и объем, то такие процессы называются, соответственно, изобарно-изотермическими или изохорно-изотермическими.
Так, например, химические реакции, протекающие в живых организмах, являются изобарно-изотермическими.
Большинство реакций, применяемых для промышленных и технических целей, осуществляется в условиях практически постоянного давления, т.е. является изобарными. Примерами изохорных реакций могут быть реакции, идущие в закрытом сосуде, реакции между твердыми телами и жидкостями без образования газа, реакции между газами, при протекании которых число молекул газа остается постоянным:
Для сравнения свойств термодинамических систем необходимо точно указать их состояние. С этой целью введено понятие – стандартное состояние, за которое для индивидуальной жидкости или твердого тела принимается такое физическое состояние, в котором они существуют при давлении в 1 атм (101315 Па) и данной температуре.
Для газов и паров стандартное состояние отвечает гипотетическому состоянию, в котором газ при давлении в 1 атм подчиняется законам идеальных газов, при данной температуре.
Величины, относящиеся к стандартному состоянию, пишутся с индексом «о» и нижним индексом указывается температура, чаще всего это 298К.
Станда́ртные состоя́ния в химической термодинамике - условно принятые состояния индивидуальных веществ и компонентов растворов при оценке термодинамических величин.
4. Первое начало термодинамики. Формулировка. Математическое выражение. Энтальпия.








