Связь химического равновесия и скорости реакции
· Обратимые реакции
· Химическое равновесие
· Принцип Ле Шателье
· Факторы, влияющие на химическое равновесие
Существуют реакции, в которых исходные вещества не полностью превращаются в продукты реакции. При этом продукты реакции могут превращаться в исходные вещества, т. е. реакция протекает как в прямом, так и в обратном направлении.
Обратимые реакции - реакции, одновременно протекающие в двух противоположных направлениях.
При записи обратимых реакций вместо знака равенства используют противоположно направленные стрелки: ↔
Обратимые реакции очень распространены. К ним относятся диссоциация воды и слабых кислот, реакции водорода с иодом и азотом, окисление оксида серы (IV) до оксида серы (VI) кислородом и многие др.
Понятие «химическое равновесие» относится к обратимым реакциям, т. е. реакциям, которые одновременно протекают в прямом и обратном направлении:
прямая реакция
aA + bB ↔ cC + dD
обратная реакция
В обратимых реакциях в начальный момент времени, когда концентрация исходных веществ велика, скорость прямой реакции максимальная. По мере уменьшения концентрации исходных веществ она уменьшается. Скорость обратной реакции, наоборот, в начальный момент минимальна и увеличивается по мере накопления продуктов прямой реакции. Через некоторое время скорость прямой реакции становится равна скорости обратной реакции.
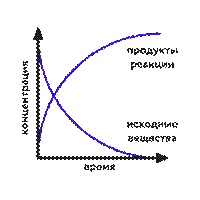
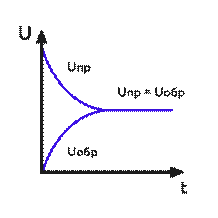
Рис. Зависимость концентрации продуктов и исходных веществ от времени.
Химическое равновесие - состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции
Химическое равновесие имеет динамический характер. Это означает, что в состоянии химического равновесия и прямая, и обратная реакции продолжают протекать, но так как их скорости равны, то концентрации всех веществ в реакционной системе не меняются. Эти концентрации называются равновесными.
Химическое равновесие устойчиво.
Это означает, что система противодействует внешним воздействиям.
Изменение внешних условий может повлиять на скорость как прямой, так и обратной реакции, что приведет к смещению равновесия. В результате этого система перейдёт в новое равновесное состояние, в котором будет другое соотношение концентраций реагирующих веществ и продуктов реакции.
Изменения, которые происходят в обратимой системе в результате внешних воздействий, определяются принципом Ле Шателье.
Принцип Ле Шателье - если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие сместится в сторону той реакции (прямой или обратной), которая ослабит это внешнее воздействие.
Связь химического равновесия и скорости реакции
Поскольку положение равновесия определяется скоростями прямой и обратной реакций, то оно зависит от тех же факторов, от которых зависит и скорость, а именно: температуры и концентрации веществ. Кроме того, на положение равновесия в реакциях с участием газов может влиять давление.








