В стереоспецифичности выделяют оптическую специфичность – избирательное действие ферментов на оптические изомеры. Например, под действием ЛДГ разрушается только L-форма молочной к-ты.
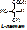
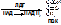
3) Влияние температуры (правило Вант-Гоффа). При увеличении температуры на 10 градусов скорость реакции увеличивается в 1,5-2 раза. Но для фермента это правило действует только до 40 градусов, т.к. дальше наступает тепловая денатурация фермента. Большинство ферментов в организме человека имеет оптимальную температуру 25-40 градусов [рис. графика: по оси х – температура, по у – процент активности. Рисуем горочку, оптимум – на 37-40°С].
Повышение активности фермента при увеличении температуры объясняется увеличением кинетической энергии реагирующих молекул, что приводит к увеличению числа столкновений между молекулами. При дальнейшем повышении температуры энергия становится чрезмерной, и внутри молекулы разрываются слабые связи – водородные, гидрофильные взаимодействия; происходит нарушение вторичной, третичной, четвертичной структуры фермента.
Ряд ферментов термостабильны, например, гликопротеины.
4) Влияние рН. Для поддержания третичной или четвертичной структуры фермента часто может быть необходимо наличие заряда на группе, удаленной от области связывания субстрата. Если же заряд этой группы меняется, то может происходить частичное развертывание белковой цепи, или компактизация, или диссоциация (олигомерные белки). Поэтому при отклонении рН от оптимального значения, фермент может потерять свою нативную структуру, в результате чего не происходит полноценного связывания активного центра с субстратом. Также при изменении рН может происходить изменение заряда на субстрате.
[рис. график. По х – рН, по у – процент активности. Рисуем горочку.]
Пепсин – 1.5-2, амилаза слюны - 6.8-7.2, трипсин - 7.5-8.6. Для большинства ферментов оптимум рН лежит в среде, близкой к нейтральной.
5) Скорость ферментативной реакции прямо пропорциональна кол-ву фермента (для небиологических катализаторов такой зависимости нет). Недостаток фермента в живом организме, например при неполноценном питании, генетических нарушениях, приводит к уменьшению скорости превращения веществ и наоборот.
6) Ферменты являются регулируемыми катализаторами. Так под действием различных веществ (активаторов и ингибиторов) меняется скорость ферментативной реакции.
Классификация и номенклатура ферментов
Согласно международной классификации, принятой в 1961 году, все ферменты делятся на 6 классов по типу катализируемой реакции. Каждый класс делится на несколько подклассов. Классы:
1. оксидоредуктазы;
2. трансферазы;
3. гидралазы;
4. лиазы;
5. изомеразы;
6. лигазы (синтетазы).
1. Оксидредуктазы – ферменты, катализирующие окислительно-восстановительные реакции. Известно 480 этих ферментов, которые делятся на 17 подклассов.
а) аэробные дегидрогеназы (оксидазы). Отщепляют водород от субстрата и переносят его на молекулу кислорода. Пр.: НАДФН2+О2= Н2О2+НАДФ.
Если кислород непосредственно внедряется в субстрат, то ферменты – оксигеназы. Наибольшее значение имеют оксидазы аминокислот.
б) анаэробные дегидрогеназы – катализируют перенос водорода от субстрата на любой другой акцептор, кроме кислорода.
CH3CH2OH → СН3СН=О
[над стрелочкой алкоголь-ДГ; под стрелочкой НАД → НАДН2 ; этанол превращается в этаналь]
в) цитохромы – это ферменты, переносящие электроны.
г) пероксидазы – гемсодержащие оксидоредуктазы. Они отщепляют водород от субстрата и переносят его на Н2О2.
Пр.: каталазная реакция
2Н2О2 → 2Н2О+О2 [над стрелочкой - каталаза].
2. Трансферазы – ферменты, переносящие группы атомов от одного субстрата к другому. При этом один субстрат донор, а другой – акцептор. В зависимости от природы переносимых групп трансферазы делят на 8 подклассов:
- аминотрансферазы, переносят NH2;
- метилтрансферазы, переносят CH3;
- фосфотрансферазы, переносят PO3H2;
- ацилтрнсферазы.
Пр. переаминирование. [рис. Аланин + альфакетоглутаровая кислота под действием АлАТ и перидоксальфосфата получается ПВК и глутаминовая к-та].
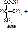
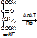
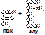
3. Гидролазы – ферменты, катализирующие разрыв одинарных связей с участием воды, присоединяемой по месту разрыва связи. Т.е. они принимают участие в реакциях гидролиза. Все ферменты пищеварительного тракта относятся к гидролазам. Всего выделяют 460 гидролаз. В зависимости от типа разрываемых связей выделяют 11 подклассов:
- эстеразы – разрывают сложно-эфирную связь. Пр.: триацилглицерид+ 3H2O=(липаза) глицерин+ 3С17H35COOH [рис. этого. Стрелочкой показать сложноэфирные связи]
- пептидазы – разрывают пептидную связь. Пр.: АЛА-ГЛИ+ H2O = (дипептидаза) АЛА+ГЛИ [рис. этого. Стрелочкой показать пептидную связь]
- гликозидазы – разрывают гликозидные связи. Пр.: мальтоза+ H2O=(мальтаза) 2глюкозы [рис. этого. Стрелочкой показать гликозидную связь]
4) Лиазы. Эти ферменты осуществляют разрыв углеродных связей без участия воды. Выделяют:
- декарбоксилазы – катализируют отщепление CO2. Пр.:
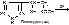
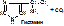
- альдолазы – катализируют расщепление связи между атомами углерода. Пр.: фруктозо-1,6-дифосфат (6 атомов С)= (альдолаза) фосфоглицериновый альдегид (3 атома С)+ дигидроксиацетонфосфат (3 атома С).
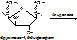
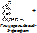
- гидратазы – разрыв двойной связи с присоединением воды по месту разрыва двойной связи.
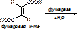
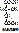
- ферменты, отщепляющие воду – реакция дегидратации. При этом образуется двойная связь.
5) Изомеразы – ферменты, катализирующие реакции изомеризации и обеспечивающие внутримолекулярную перестройку.
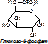
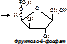
6) Лигазы (синтетазы) – катализируют образование более сложных веществ из более простых. При этом требуется энергия из вне. Обязательно участие АТФ или других трифосфатов (УТФ, ЦТФ и т.д.). [Пр. Аспарагиновая к-та + аммиак + АТФ под действием аспарагинсинтетазы превращается в аспарагин + АМФ + неорганический фосфат +энергия].
Номенклатура ферментов
1) Существует тривиальная номенклатура – названия случайные, без системы и основания, например трипсин, пепсин, химотрипсин.
2) Рабочая номенклатура – название фермента составляется из названия субстрата или продукта реакции, типа катализируемой реакции и окончание –аза, например лактатдегирогеназа.
3) Систематическая, научная - L-лактат-НАД-оксидредуктаза.
4) Все ферменты имеют цифровой шифр, например ЛДГ - 1.1.1.27.
Первая цифра говорит о типе катализируемой реакции, указывая на номер класса.
Вторая уточняет действие фермента – номер подкласса.
Третья указывает природу разрываемой связи в молекуле субстрата - подподкласс.
Четвёртая – порядковый номер фермента.








