Методы разделения (фракционирования) белков
1. Высаливание – разделение на основе различной растворимости альбуминов и глобулинов. Осаждение белков обычно производят сульфатом аммония (NH4)2SO4. В насыщенном растворе этого реактива осаждаются альбумины, а в полунасыщенном – глобулины.
2. Электрофорез – разделение белков при движении в электрическом поле за счет разности их заряда.
Основные белки сыворотки крови делятся на несколько фракций. Быстрее всех движутся к аноду альбумины – это гомогенная фракция. Глобулины делятся на 4 фракции: a1, a2, b, g [рис. альбуминов и 4-х глобулинов и как они движутся к аноду].
В крови определяется общий белок. Нормальное общее содержание белка, но изменено соотношение его фракций – диспротенемия. При инфекционных заболеваниях увеличивается содержание g-глобулиновой фракции. При заболеваниях почек снижается содержание альбуминовой фракции, но увеличивается содержание a2 и b глобулинов. Также наблюдается парапротеинемия – появление патологических белков, например при некоторых онкологических заболеваниях.
III. Проламины и глютелины. Это основные растительные белки. Они не растворяются ни в водных растворах, ни в свободном этаноле, но растворяются в 65% растворе этанола. По АК-составу присутствует глутамин (до 25%), пролин (до 15%). В кукурузе содержится зеин, в ячмене – гордеин, в пшенице – глиадин.
IV. Протеиноиды (склеропротеины). Они не растворяются ни в воде, ни в солевых растворах. Это фибриллярные белки опорных тканей. Входят в состав сухожилий, костной, хрящевой тканей и др. К ним относятся: кератины – белки волос, ногтей; коллагены – белки соединительной ткани; эластины – белки, входящие в состав связок. Особенностью АК-состава является повышенное содержание аланина, глицина, пролина. Имеется оксипролин. Эти белки составляют 25-33% от всех белков в организме.
Характеристика сложных белков
Они имеют белковую и небелковую (простетическую) части. Белковую часть составляет полипептид, построенный из АК-остатков. В состав небелковой части может входить: гем, металл, остаток фосфорной кислоты, углеводы, липиды и т.д.
Хромопротеины
Для них простетическая часть окрашена (chromos – краска). К хромопротеинам относятся гемоглобин, миоглобин, каталаза, пероксидаза, ряд флавинсодержащих ферментов (сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза), цитохромы (гемсодержащие белки) и т.д. Велика биологическая роль этих белков – участвуют в физиологических процессах: дыхание клетки, транспорте кислорода и углекислого газа, окислительно-восстановительных процессах.
Гемоглобин. Его белковая часть представлена глобином, небелковая – гемом. Это олигомерный белок, т.е. имеет четвертичную структуру, состоящую из 4 субъединиц.
a цепи построены из 141 АК-остатка.
b цепи из 146 АК-остатков [рис. 4-х субъединиц, в каждой нарисована точка - гем].
Каждая из субъединиц связана с гемом:
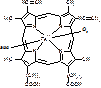 [гем]
[гем]
Основная функция гемоглобина – транспортная (кислород, углекислый газ). Также он представляет собой основную буферную систему крови (75% от всей буферной емкости крови).
Различают:
- HbO2 – оксигемоглобин (связан с молекулой O2);
- HbCO – карбоксигемоглобин;
- HbCO2 – карбгемоглобин;
- HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород).
Типы гемоглобина. Всего известно более 100 типов, но их все делят на 2 группы:
1) Физиологические гемоглобины;
2) Патологические (аномальные).
К физиологическим гемоглобинам относятся:
- Hb P – примитивный гемоглобин, имеет место быть у 1-2 недельного эмбриона;
- Hb F – фетальный или гемоглобин плода, к моменту рождения составляет около 70% всего гемоглобина в крови;
- Hb A, Hb A2, Hb A3 – это гемоглобины взрослого организма. На Hb A приходится около 90-96%.
Физиологические типы гемоглобинов отличаются глобулиновой частью (АК-составом). Например Hb A содержит 2a и 2b субъединицы, а Hb F – 2a и 2g субъединицы.
К аномальным (возникающих при наследственных заболеваниях) гемоглобинам относятся:
- HbS – гемоглобин, сопутствующий серповидно-клеточной анемии. Отличается от нормального тем, что с N-конца в 6 положении b–цепи глутамин заменен на валин.
Миоглобин по сравнению с гемоглобином имеет третичную структуру, одну полипептидную цепь, один гем и может связывать одну молекулу кислорода. Гемоглобин и миоглобин функционируют вместе. Гемоглобин доставляет кислород из легких к тканям, а миоглобин перераспределяет его внутри клетки (доставляет к митохондриям).
Оба белка – гемопротеины, т.е. гемсодержащие белки.








