Тема урока « Великий углерод! »
I .Углерод– химический элемент.
1. История открытия.
Углерод – «рождающий уголь».
2. Дайте характеристику элемента углерода, используя ПСХЭМ и учебник (§28).
1) систематическое положение в ПСХЭМ (укажите N(С), №(П), №(Г), подгруппа
2) строение атома (зарисуйте схему строения)
3) укажите возможные с. о. (С)
4)
5) В земной коре 0,1 % по массе.
II . Углерод – простое вещество.
1. Аллотропные модификации углерода.
Прочитайте текст в учебнике, дополнительные источники информации, интернет - ресурсы и заполните таблицу:
| Свойства | Алмаз | Графит | Карбин |
| 1.Состав. | Сn | Сn | Сn |
| 2.Кристаллическая решетка | |||
| 3. Физические свойства | |||
| 4. Применение |
Эти аллотропы могут взаимопревращаться.
10 Па, 1000С
 Графит Алмаз
Графит Алмаз
 10 Па, 2000С
10 Па, 2000С
Аморфный углерод (мелкокристаллический графит)– древесный уголь, сажа, кокс.
2 Прочитайте текст и выполните задания:
Одно из интереснейших свойств угля описано в сказке Владимира Федоровича Одоевского «Мороз Иванович». «…Между тем Рукодельница воротится, воду процедит, в кувшины нальет, да еще какая затейница: коли вода нечиста, так свернем лист бумаги, наложит в неё угольков да песку крупного насыплет, вставит ту бумагу в кувшин да нальет в неё воды, а вода – то, знай проходит сквозь песок да сквозь уголья и капает в кувшин чистая, чистая, словно хрустальная…»
Ответьте на вопросы:
а) Что такое адсорбция?
б) Что такое активированный уголь(карболен)?
в) Что такое десорбция? Запишите определения в тетрадь.
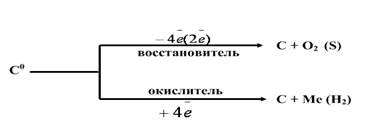
3. Химические свойства углерода
Заполните таблицу.
| Восстановительные свойства | Окислительные свойства |
| 1. С простыми веществами: а) с кислородом - горение С + O2 (избыток) = CO2 – полное окисление 2С + О2(недост)= = 2СО – неполное окисление б) с > ЭО неметаллами С + 2S = CS2 (сероуглерод) С + 2F2 = CF4 2. Со сложными веществами: а) с водяным паром при нагревании Н2O + С = СО + Н2 (синтез - газ) б) восстанавливает многие металлы из их оксидов: 2CuO + C = 2Cu+ СО2 Выполните №5 стр.134 в) с кислотами – сильными окислителями С + HNO3(конц) → СО2 + NO2 + H2O С+ H2 SO4конц. = CO2+SО2-+H2O Разберите реакции как ОВР и расставьте коэффициенты методом электронного баланса. Вывод: Углерод – … восстановитель. | 1. С простыми веществами:
а) с < ЭО неметаллами
С + 2H2  CH4 (метан)
С + Si = SiС
б) с металлами углерод образует карбиды:
4Al + 3C = Al4C3
2. Со сложными веществами:
а) с оксидами металлов
CaO + 2C = CaC2 + СО CH4 (метан)
С + Si = SiС
б) с металлами углерод образует карбиды:
4Al + 3C = Al4C3
2. Со сложными веществами:
а) с оксидами металлов
CaO + 2C = CaC2 + СО
|
4. Применение углерода
Составьте схему, используя рисунок в тексте параграфа.
5. Получение:
- в промышленности
а) сухая перегонка древесины, каменного угля, древесного угля, кокса;
б) пиролиз метана:
CH4 = C + 2H2 (t =10000С )
метан
Домашнее задание:
§28, конспект, выполнить задания, перечисленные в рабочем листе.
На 4 и5 решить задачу: Какую массу железа можно восстановить коксом из 640 г оксида железа (III) если практический выход железа составляет 85%?








